Г магния выделяется 25,6 кДж теплоты.
| Последовательность действий | Пример выполнения действий |
| 1.Запишите условие и требование задачи с помощью общепринятых обозначений | Дано: m(Мg)=1 г Q=25,6 кДж Найти: Q' - ? |
| 2. Чтобы составить термохимическое уравнение реакции, нужно вычислить тепловой эффект реакции, написать уравнение горения магния и указать в нем значение этой величины. | |
| 3.Составьте уравнение химической реакции. | Решение: 2Мg + O2→ 2МgО |
| 4.При анализе условия и уравнения горения магния делают вывод, что, для того чтобы найти тепловой эффект реакции, нужно вычислить количество теплоты, которое выделится при сгорании 2 моль | |
| 5.В уравнении подчеркните, что записано в «Дано» | 2Мg + O2→ 2МgО |
| 6.Под подчеркнутой формулой подписать моли: | 2Мg + O2→ 2МgО 2 моль |
| 7.Вычислите количество вещества n, которое записано в «Дано». | 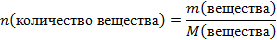 n(Мg) = n(Мg) = 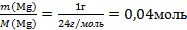 |
| 8.Подпишите найденное n под формулой этого вещества | 2Мg + O2→ 2МgО 2 моль 0,04 моль |
| 9.Составим пропорцию: | при сгорании 0,04 моль магния выделится 25,6 кДж теплоты при сгорании 2 моль магния выделится х кДж теплоты |
| 10.Из полученной пропорции выразить х | 0,04 моль 25,6 кДж 2 моль х кДж х = 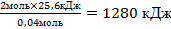 |
| 11. Запишите ответ | 2Мg + O2→ 2МgО + 1280 кДж |
Пример 3. На гидроксид натрия, взятый в необходимом количестве, подействовали раствором, содержащим 252 г азотной кислоты. Вычислите массу полученной соли, если практический выход составляет 90 % от теоретического.
Количество продукта, рассчитанное по уравнению, является максимально возможным значением (теоретическое значение,mтеор). На практике из-за потерь обычно получают меньшее количество (практическое значение,mпракт., mпракт < mтеор).
Практический выход продукта определяется отношением его практического количества к теоретическому: ᶮ= 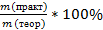
При получении продукта в газообразном или жидком состоянии часто определяют отношение не масс, а объемов готового вещества. В этом случае вычисляют объемную долю выхода продукта: ᶮ= 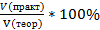
| Последовательность действий | Пример выполнения действий |
| 1.Запишите условие и требование задачи с помощью общепринятых обозначений | Дано: m(НNО3)=252 г ᶮ(соли)=90% Найти: m(соли)-? |
| 2.Составьте уравнение химической реакции. Рассчитайте массу соли по уравнению – это теоретическая масса соли | Решение: NаОН + НNO3→ NаNO3+Н2О |
| 3.В уравнении подчеркните формулы веществ, которые записаны в «Дано» и «Найти» | NаОН + НNO3→ NаNO3+Н2О |
| 5.Под подчеркнутыми формулами подписать по коэффициентам «моли» | NаОН + НNO3→ NаNO3+Н2О 1 моль 1 моль |
| 6.Вычислите количество вещества n, которое записано в «Дано». | 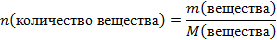 n(НNO3) = n(НNO3) = 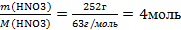 |
| 7.Подпишите найденное n под формулой этого вещества | NаОН + НNO3→ NаNO3+Н2О 1 моль 1 моль 4 моль |
| 8.Под формулой вещества, массу которого надо найти, поставим х моль | NаОН + НNO3→ NаNO3+Н2О 1 моль 1 моль 4 моль х моль |
| 9.Из полученной пропорции выразить х | 1 моль 1 моль 4 моль х моль х = 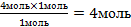 – это количество вещества n(NаNO3) – это количество вещества n(NаNO3) |
| 10.Зная n(NаNO3) найдите массу NаNO3 | m=nM m (NаNO3)= n (NаNO3) 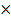 M (NаNO3) M (NаNO3=23+ 14+16 M (NаNO3) M (NаNO3=23+ 14+16 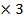 =85г/моль m(NаNO3)=4 =85г/моль m(NаNO3)=4 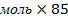 г/моль=340г – теоретическая масса соли г/моль=340г – теоретическая масса соли |
| 11.Вычислите практическую массу полученной соли | 340 г - 100% Х г - 90% х = 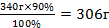 - практическая масса NаNO3 - практическая масса NаNO3 |
| 11.Запишите ответ | Ответ: m (NаNO3) =306 г |
Контрольные задания
Подготовьте сообщения
1. Понятие об электролизе. Электролиз расплавов. Электролиз растворов. Электролитическое получение алюминия. Практическое применение электролиза.
2.Гальванопластика. Гальваностегия. Рафинирование цветных металлов. (Указание: что это такое, применение).
3.Катализ. Гомогенные и гетерогенные катализаторы. Промоторы. Каталитические яды. Ингибиторы (Указание: что это такое, применение).
4.Производство аммиака: сырье, аппаратура, научные принципы.
Решите задачи
ВНИМАНИЕ! Условие задач необходимо списывать.
Задача 1.
1. При соединении 4,2 г железа с серой выделилась теплота, соответствующая 7,15 кДж. Составьте термохимическое уравнение этой реакции.
2. Термохимическое уравнение реакции разложения известняка:
СаСО3→ СаO+СО2 – 157 кДж. Какое количество теплоты затрачивается на разложение 20 г известняка?
3. При сжигании 6,5 г цинка выделилась теплота, соответствующая 34,8 кДж. Составьте термохимическое уравнение этой реакции.
4. Термохимическое уравнение реакции горения фосфора:4Р+5О2→2Р2О5 +3010 кДж. Сколько теплоты выделится при сгорании 31 г фосфора?
5. При соединении 18 г алюминия с кислородом выделяется 547 кДж теплоты. Составьте термохимическое уравнение этой реакции.
6. Термохимическое уравнение реакции оксида меди (II) с соляной кислотой:
СuО + 2НСl→ СuCl2+Н2О +63,6 кДж. Какое количество теплоты выделится при растворении 200 г оксида меди с соляной кислотой?
7. Путем сжигания серы получено 32 г оксида серы (IV), причем выделилась теплота, соответствующая 146,3 кДж. Составьте термохимическое уравнение этой реакции.
8. Термохимическое уравнение реакции горения метана:
СН4 + 2О2→ СО2+2Н2О +878 кДж. Какое количество теплоты выделится при сгорании 4,48 л (н.у.) метана?
9. При сжигании 6,08 г магния выделилась теплота, соответствующая 152,5 кДж. Составьте термохимическое уравнение образования оксида магния.
10. Термохимическое уравнение реакции сгорания ацетилена:
2С2Н2 + 5О2→ 4СО2+2Н2О +2610 кДж. Какое количество теплоты выделится при сгорании 13 г ацетилена?
11. При сжигании 6,5 г цинка выделилась теплота, соответствующая 34,8 кДж. Составьте термохимическое уравнение этой реакции.
12. Термохимическое уравнение реакции горения этилена:
С2Н4 + 3О2→ 2СО2+2Н2О +1400 кДж. Какое количество теплоты выделится, если в реакцию вступило 16 г кислорода?
13. При соединении 18 г алюминия с кислородом выделяется 547 кДж теплоты. Составьте термохимическое уравнение этой реакции.
14. Термохимическое уравнение реакции сгорания ацетилена:
2С2Н2 + 5О2→ 4СО2+2Н2О +2610 кДж. Какое количество теплоты выделится, если будет израсходовано 1,12 л ацетилена?
15. Путем сжигания серы получено 32 г оксида серы (IV), причем выделилась теплота, соответствующая 146,3 кДж. Составьте термохимическое уравнение этой реакции.
16. Термохимическое уравнение реакции сгорания ацетилена:
2С2Н2 + 5О2→ 4СО2+2Н2О +2610 кДж. Какое количество теплоты выделится, если будет израсходовано 1моль ацетилена?
17. При сжигании 6,08 г магния выделилась теплота, соответствующая 152,5 кДж. Составьте термохимическое уравнение образования оксида магния.
18. Термохимическое уравнение реакции горения этилена:
С2Н4 + 3О2→ 2СО2+2Н2О +1400 кДж. Какое количество теплоты выделится, если в реакцию вступило 336 л (н.у) кислорода?
19. Термохимическое уравнение реакции горения этилена:
С2Н4 + 3О2→ 2СО2+2Н2О +1400 кДж. Какое количество теплоты выделится, если в реакцию вступило 1 моль кислорода?
20. При соединении 4,2 г железа с серой выделилась теплота, соответствующая 7,15 кДж. Составьте термохимическое уравнение этой реакции.
21. Термохимическое уравнение реакции разложения известняка:
СаСО3→ СаO+СО2 – 157 кДж. Какое количество теплоты затрачивается на разложение 20 г известняка?
22. При сжигании 6,5 г цинка выделилась теплота, соответствующая 34,8 кДж. Составьте термохимическое уравнение этой реакции.
23. Термохимическое уравнение реакции горения фосфора:4Р+5О2→2Р2О5 +3010 кДж. Сколько теплоты выделится при сгорании 31 г фосфора?
24. При соединении 18 г алюминия с кислородом выделяется 547 кДж теплоты. Составьте термохимическое уравнение этой реакции.
25. Термохимическое уравнение реакции оксида меди (II) с соляной кислотой:
СuО + 2НСl→ СuCl2+Н2О +63,6 кДж. Какое количество теплоты выделится при растворении 200 г оксида меди с соляной кислотой?
26. Путем сжигания серы получено 32 г оксида серы (IV), причем выделилась теплота, соответствующая 146,3 кДж. Составьте термохимическое уравнение этой реакции.
27. Термохимическое уравнение реакции горения метана:
СН4 + 2О2→ СО2+2Н2О +878 кДж. Какое количество теплоты выделится при сгорании 4,48 л (н.у.) метана?
28. При сжигании 6,08 г магния выделилась теплота, соответствующая 152,5 кДж. Составьте термохимическое уравнение образования оксида магния.
29. Термохимическое уравнение реакции сгорания ацетилена:
2С2Н2 + 5О2→ 4СО2+2Н2О +2610 кДж. Какое количество теплоты выделится при сгорании 13 г ацетилена?
30. Термохимическое уравнение реакции горения этилена:
С2Н4 + 3О2→ 2СО2+2Н2О +1400 кДж. Какое количество теплоты выделится, если в реакцию вступило 16 г кислорода?
31. Термохимическое уравнение реакции сгорания ацетилена:
2С2Н2 + 5О2→ 4СО2+2Н2О +2610 кДж. Какое количество теплоты выделится, если будет израсходовано 1,12 л ацетилена?
32. Термохимическое уравнение реакции сгорания ацетилена:
2С2Н2 + 5О2→ 4СО2+2Н2О +2610 кДж. Какое количество теплоты выделится, если будет израсходовано 1моль ацетилена?
33. Термохимическое уравнение реакции горения этилена:
С2Н4 + 3О2→ 2СО2+2Н2О +1400 кДж. Какое количество теплоты выделится, если в реакцию вступило 336 л (н.у) кислорода?
34. Термохимическое уравнение реакции горения этилена:
С2Н4 + 3О2→ 2СО2+2Н2О +1400 кДж. Какое количество теплоты выделится, если в реакцию вступило 1 моль кислорода?
Задача 2
1. При прокаливании избытка оксида бария и 2,75 моль оксида кремния(IV) получили ВаSiО3. Вычислите массу полученной соли, если практический выход полученной соли составляет 95% от теоретического.
2. При взаимодействии 9,84 г оксида железа (III) и монооксида углерода СО получается 5,73 г железа и выделяется углекислый газ. Рассчитайте практический выход (в %) железа.
3. Цинк массой 65 г окисляется кислородом с образованием оксида цинка. Вычислите массу полученного оксида, если практический выход оксида составляет 85% от теоретического.
4. Рассчитайте объем в л. (н.у.) оксида азота (IV), который можно получить окислением 58,5 моль азота, если практический выход составляет 39%.
5. Рассчитайте, какую массу оксида серы (IV) можно получить при взаимодействии 50 г серы с кислородом, если практический выход процесса равен 45%.
6. Рассчитайте объем в л. (н.у.) кислорода, который можно получить, в процессе разложения 15,38 г бертолетовой соли КСlО3 на КСl и О2, если практический выход кислорода составляет 89%.
7. Какую массу меди можно получить при восстановлении углем 160 г оксида меди (II), если массовая доля выхода меди составляет 85%?
8. Вычислите объем в л. (н.у.) аммиака NН3, который можно получить, нагревая 20 г хлорида аммония с избытком гидроксида кальция, если практический выход аммиака составляет 98 %. Продукты реакции: аммиак, хлорид кальция, вода.
9. При нагревании нитрита аммония NН4NО2 образуется азот и вода. Вычислите объем азота (н.у.), который можно получить при разложении 6,4 г нитрита аммония, если объемная доля выхода азота составляет 89%.
10. Оксид бария взаимодействует с алюминием с образованием оксида алюминия и бария. Вычислите массовую долю выхода бария, если из 4,59 г оксида бария было получено 3,8 г бария.
11. Фосфор массой 3,1 г сгорает в кислороде с образованием оксида фосфора (V). Вычислите массу полученного оксида, если практический выход оксида составляет 95% от теоретического.
12. Из 280 г оксида кальция при взаимодействии с водой получили 358 г гидроксида кальция. Вычислите массовую долю выхода гидроксида кальция.
13. Азот объемом 56 л (н.у.) прореагировал с водородом, взятым в избытке. Массовая доля выхода полученного аммиака составила 50 %. Рассчитайте объем полученного аммиака.
14. Алюминий массой 3,4 г окисляется кислородом с образованием оксида алюминия. Вычислите массу полученного оксида, если практический выход оксида составляет 75% от теоретического
15. Рассчитайте, какой объем (н.у) водорода можно получить при растворении в разбавленной серной кислоте 112 г железа, если объемная доля выхода водорода составляет 98 %.
16. Гидроксид кальция реагирует с 6,3 г азотной кислоты. Какая масса нитрата кальция получится, если массовая доля выхода составляет 98%?
17. Из 140 г оксида кальция при растворении в воде получили 182 г гидроксида кальция. Вычислите массовую долю выхода гидроксида кальция.
18. При взаимодействии 6,9 г натрия с водой получили 3 л водорода (н.у.). Вычислите объемную долю выхода газа (в %).
19. Какую массу железа можно получить из 960 г оксида железа (III) при восстановлении его оксидом углерода (II), если массовая доля выхода составляет 90 %. (продукты реакции: железо и углекислый газ).
20. При прокаливании избытка оксида кальция и 2,5 г оксида кремния(IV) получили СаSiО3. Вычислите массу полученной соли, если практический выход полученной соли составляет 85% от теоретического.
21. При взаимодействии 9,84 г оксида железа (III) и монооксида углерода СО получается 5,73 г железа и выделяется углекислый газ. Рассчитайте практический выход (в %) железа.
22. Рассчитайте, какой объем (н.у) водорода можно получить при растворении в разбавленной соляной кислоте 6,5 цинка, если объемная доля выхода водорода составляет 90 %.
23. Рассчитайте объем в л. (н.у.) оксида азота (IV), который можно получить окислением кислородом 28 г азота, если практический выход составляет 90 %.
24. Рассчитайте, какую массу оксида серы (IV) можно получить при взаимодействии 3,2 г серы с кислородом, если практический выход процесса равен 75%.
25. Рассчитайте объем в л. (н.у.) кислорода, который можно получить, в процессе разложения 2,5 моль бертолетовой соли КСlО3 на КСl и О2, если практический выход кислорода составляет 80%.
26. Какую массу меди можно получить при восстановлении углем 80 г оксида меди (II), если массовая доля выхода меди составляет 75%?
27. Вычислите объем в л. (н.у.) аммиака NН3, который можно получить, нагревая
2 моль хлорида аммония с избытком гидроксида кальция, если практический выход аммиака составляет 98 %. Продукты реакции: аммиак, хлорид кальция, вода.
28. При нагревании нитрита аммония NН4NО2 образуется азот и вода. Вычислите объем азота (н.у.), который можно получить при разложении 10 г нитрита аммония, если объемная доля выхода азота составляет 89%.
29. Оксид бария взаимодействует с алюминием с образованием оксида алюминия и бария. Вычислите массовую долю выхода бария, если из 4,59 г оксида бария было получено 3,8 г бария.
30. Фосфор количеством 1 моль сгорает в кислороде с образованием оксида фосфора (V). Вычислите массу полученного оксида, если практический выход оксида составляет 95% от теоретического.
31. Магний массой 2,4 г сгорает в кислороде с образованием оксида магния. Вычислите массу полученного оксида, если практический выход оксида составляет 75% от теоретического.
32. Рассчитайте, какой объем (н.у) водорода можно получить при растворении в разбавленной серной кислоте 5,5 моль цинка, если объемная доля выхода водорода составляет 88 %.
33. Рассчитайте объем в л. (н.у.) оксида азота (IV), который можно получить окислением кислородом 2,8 г азота, если практический выход составляет 98 %.
34. Гидроксид натрия реагирует с 6,3 г азотной кислоты. Какая масса нитрата натрия получится, если массовая доля выхода соли составляет 98%?
