Поляризуемость ковалентной связи
Поляризуемостью называют свойство ковалентной связи менять свою полярность под влиянием других химических связей в том же соединении или под влиянием внешних электромагнитных полей.
В качестве примера (рисунок 3.9) можно рассмотреть различие в кислотных свойствах уксусной и дихлоруксусной кислот (ДХУ), которое используется в технологии химволокон:
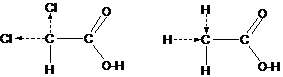
дихлоруксусная уксусная
Рисунок 3.9 – Смещение электронной плотности связей в молекулах дихлоруксусной и уксусной кислот
Кислотные свойства всех оксокислот, органических и неорганических, определяются свойствами связи –O–H диссоциировать по кислотному типу, с отщеплением иона водорода. В то же время, если рассматривать эту связь изолированно от других связей, различие в ее свойствах и соответственно различие в силе кислот окажется непонятным. Из всех рассмотренных выше свойств химических связей (длина, энергия, кратность, полярность) причиной изменения свойств связи водород–кислород можно объяснить изменением ее полярности под влиянием других связей в том же соединении.
Действительно, в ДХУ вследствие того, что ОЭОCl > ОЭОC, но ОЭОC > ОЭОН, электронная плотность на дихлорметильном атоме углерода будет меньше, чем на метильном атоме углерода в уксусной кислоте (рисунок 3.9). По этой причине произойдет перераспределение (поляризация) связей в карбоксильных группах, в т.ч. связи –О–Н: молекуле ДХУ она станет более полярной, По этой причине ДХУ сильнее уксусной (почти в 1000 раз).
Аналогично можно объяснить увеличение кислотных свойств оксокислот галогенов, халькогенов, азота с увеличением степени окисления элемента или его природы. Так, например, хлорноватистая кислота (HClO) – слабейшая из оксокислот хлора, а хлорная – самая сильная (степень окисления хлора – наибольшая). В свою очередь, HClO сильнее, чем HIO (т. к. хлор – неметалличнее, чем иод).
Влияние внешних электромагнитных полей на полярность химических связей и реакционную способность веществ исследуется в сравнительно молодой области химии, называемой магнетохимией. (Вполне вероятно, что ухудшение самочувствия живых организмов в период солнечной активности можно объяснить, в том числе, электромагнитными бурями).
Ионная связь
Отличительные особенности ковалентной связи – направленность и насыщаемость. В то же время известны химические соединения, для которых такие свойства нехарактерны. Например, в соединениях, которые называют «ионными», связь свойств направленности и насыщаемости не проявляет.
Природу такой связи можно объяснить электростатическим притяжением ионов с противоположными по знаку зарядами. Однако даже при образовании связи между атомами с наибольшей DЭОЭ, она не будет ионной на 100 %: так, в соединении Cs–F эффективные заряды атомов по 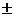 0,97.
0,97.
Ионная связь – это случай предельной поляризации ковалентной связи при образовании ионного кристалла. Структура элементарной кристаллической решетки ионного соединения определяется не столько строением валентного уровня атомов, сколько соотношением радиусов и зарядов ионов, которыми она образована. В большинстве простых солей, например галогенидов щелочных металлов, при соотношении радиусов катиона и аниона, rкатиона/rаниона = = 0,73 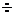 0,41 ионный кристалл имеет простую кубическую структуру с числом ближайших ионов противоположного знака, равным шести (NaCl). При соотношении радиусов 0,73
0,41 ионный кристалл имеет простую кубическую структуру с числом ближайших ионов противоположного знака, равным шести (NaCl). При соотношении радиусов 0,73 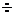 1,37 каждый ион окружен восемью ионами с противоположным зарядом – объемно-центрированная кубическая структура (CsCl). Ионные кристаллы относят к наиболее распространенному типу кристаллических веществ. Варианты образования кристаллов с другими типами связей будут подробнее рассмотрены в химии элементов («Нерганической химии»).
1,37 каждый ион окружен восемью ионами с противоположным зарядом – объемно-центрированная кубическая структура (CsCl). Ионные кристаллы относят к наиболее распространенному типу кристаллических веществ. Варианты образования кристаллов с другими типами связей будут подробнее рассмотрены в химии элементов («Нерганической химии»).
Метод молекулярных орбиталей (основные положения)
Согласно этой модели, ковалентная химическая связь образуется в результате перекрывания попарно валентных орбиталей атомов. При этом каждая пара атомных орбиталей (АО) образует пару молекулярных орбиталей (МО), из которых одна – с энергией более низкой, чем исходные АО (ее называют связывающей МО), а другая – с энергией большей, чем исходные АО (ее называют разрыхляющей молекулярной орбиталью). Способы перекрывания орбиталей, по σ- или π- типу, аналогичны рассмотренным ранее в методе валентных связей (см. рисунок 3.5). Соответственно способу перекрывания орбиталей называют образующиеся молекулярные орбитали: если две АО перекрылись по σ- типу, то в результате образуются две σ-МО (σ- связывающая и σ*- разрыхляющая, рисунок 3.10, 3.11); если две АО перекрылись по π-типу, то в результате образуются две π- МО (π- связывающая и π*- разрыхляющая).
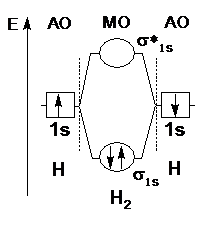 | 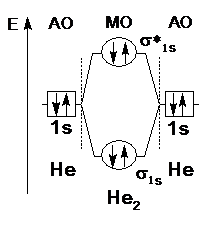 |
| Рисунок 3.10 – Энергетическая диаграмма МО молекулы Н2 | Рисунок 3.11 – Энергетическая диаграмма МО молекулы Не2 |
На рисунке 3.12 показаны энергетические диаграммы атомных орбиталей (АО) валентного уровня двух атомов кислорода и молекулярных орбиталей (МО) молекулы О2.
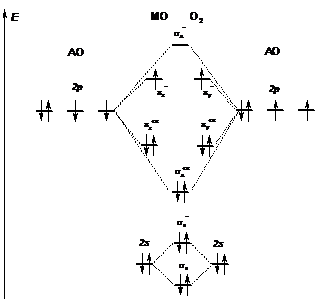
Рисунок 3.12 – Энергетическая диаграмма орбиталей (АО) атомов кислорода и молекулярных орбиталей (МО) молекулы кислорода О2
Из рисунка 3.12 видно, что число молекулярных орбиталей равно числу атомных орбиталей – их восемь; из них четыре связывающие и четыре разрыхляющие. Распределение электронов на МО подчиняется принципу наименьшей энергии, принципу Паули и правилу Гунда (см. тему 3). В соотвествии с этим двенадцать валентных электронов двух атомов кислорода при образовании молекулы О2 распределяются по МО следующим образом: 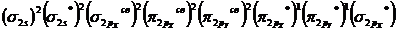 – электронная конфигурация МО молекулы О2.
– электронная конфигурация МО молекулы О2.
Вместо понятия валентность (МВС) в методе молекулярных орбиталей вводится понятие порядок химической связи – это разность между числом электронных пар на связывающих и разрыхляющих орбиталях (одиночный электрон считают ½ электронной пары).
В молекуле Н2 (рисунок 3.10) порядок связи равен 1, в молекулярном ионе Н2+ он равен 0,5. В молекуле Не2 (рисунок 3.11) порядок связи равен нулю – в подобных случаях связь не образуется (а в молекулярном ионе Не+?).
В молекуле О2 (рисунок 3.12) на связывающих орбиталях – четыре электронных пары, а на разрыхляющих – две; следовательно, порядок связи в О2 равен 4 – 2 = 2 (т.е. в данном случае порядок связи в модели ММО численно совпадает с «валентностью» в представлениях МВС). В общем случае порядок связи может быть не только целым, но и дробным. Например, молекулярный ион О2–, в отличие от О2, имеет дополнительный электрон, который занимает π*- орбиталь, и в этом случае порядок связи будет 4 – 2,5 = 1,5; следовательно связь в О2– менее прочная, чем в О2 (сравните с ним О2+).
Из рисунка 3.12 видно также, что в молекуле О2 два электрона неспаренные, и поэтому молекулярный кислород должен проявлять свойство парамагнетизма (что соответствует действительности, хотя по МВС молекулярный кислород не должен иметь неспаренных электронов и поэтому должен быть диамагнитным).
Как видно из приведенных примеров, метод молекулярных орбиталей – модель с гораздо большими возможностями прогнозирования свойств химических соединений.
В настоящее время в химической теории используются не только рассмотренные нами модели МВС и ММО. Так, при изучении комплексных соединений будет рассмотрена еще одна модель химической связи – теория кристаллического поля лигандов. Для прогнозирования геометрии химических соединений часто гораздо эффективнее теории гибридизации орбиталей оказывается модель, предложенная Гиллеспи – теория взаимного отталкивания валентных электронов атомов в соединении.
