Ионное произведение воды и водородный показатель
Измерение электропроводности химически чистой воды показало, что она обладает незначительной электропроводностью, т.е. в очень малой степени находится в диссоциированном состоянии (слабый электролит).
H2O  H++OH –
H++OH –
К её диссоциации можно применять закон действующих масс
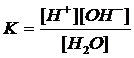 .
.
Константу диссоциации можно вычислить по данным электропроводности. При 22оС она равна 1,8∙10-16, а степень диссоциации 2,9∙10-9, т.е. из 555000000 молекул воды диссоциирует только одна. При такой ничтожно малой диссоциации концентрацию недиссоциированных молекул воды H2O можно полагать равной концентрации общего количества воды, считать величиной постоянной и включить в константу диссоциации
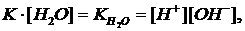
т.е. произведение концентраций ионов водорода и гидроксильной группы в любом водном растворе есть величина постоянная (при данной температуре) и называется ионным произведением воды. Можно вычислить 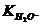
Концентрация как недиссоциированных, так и исходных молекул воды 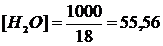 моль/литр. Подставив эту величину в выражение для ионного произведения воды, получим
моль/литр. Подставив эту величину в выражение для ионного произведения воды, получим
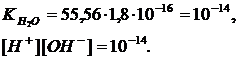
Как было отмечено, степень диссоциации воды повышается с повышением температуры. Поэтому с повышением температуры увеличивается концентрация [H+] и [OH–] ионов и величина ионного произведения; так, при 100 оС [H+][OH–] = 59∙10-14 , при 0 оС [H+][OH–] = 0,139∙10-14.
В воде и в любом водном растворе содержатся [H+]- и [ОН-]-ионы, их относительной концентрацией определяется реакция среды – кислая, щелочная или нейтральная.
В нейтральных растворах и в чистой воде (при 22оС)
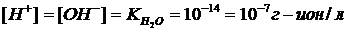 .
.
Эта величина концентрации водородных ионов соответствует нейтральной реакции среды.
В кислых растворах равновесие Н2О  H+ + OH– смещено влево, в сторону моляризации избытка одноименных Н+-ионов, но ионное произведение воды – величина при данной температуре постоянная, в любой среде (кислой, щелочной, нейтральной) также сохраняется его значение
H+ + OH– смещено влево, в сторону моляризации избытка одноименных Н+-ионов, но ионное произведение воды – величина при данной температуре постоянная, в любой среде (кислой, щелочной, нейтральной) также сохраняется его значение 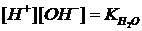 . Но при этом [H+]>[OH-]. Величина концентрации Н+-ионов обусловливает кислую реакцию среды [H+]>10-7 г-ион/л.
. Но при этом [H+]>[OH-]. Величина концентрации Н+-ионов обусловливает кислую реакцию среды [H+]>10-7 г-ион/л.
В щелочных растворах равновесие диссоциации воды также смещено влево от избытка одноименных ОН–-ионов; величина ионного произведения воды также сохраняется, причем [H+]<[OH-]; причиной щелочной реакции среды может быть концентрация ОН–-ионов (>10-7) или также концентрация Н+-ионов (<10-7) согласно 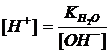 . Таким образом, концентрация Н+-ионов может быть использована для характеристики любой реакции среды. Характеристика реакции среды обычно выражается очень малыми величинами с отрицательными показателями степени. Для большего удобства принято пользоваться отрицательным значением логарифма величины [H+], который назван водородным показателем, обозначается рН:
. Таким образом, концентрация Н+-ионов может быть использована для характеристики любой реакции среды. Характеристика реакции среды обычно выражается очень малыми величинами с отрицательными показателями степени. Для большего удобства принято пользоваться отрицательным значением логарифма величины [H+], который назван водородным показателем, обозначается рН:
рН = –lg [H+] [H+] = 10–pH
Если реакция среды нейтральная, то [H+]=10–7, а рН=7.
Если реакция кислая, то [H+]>10–7, а рН<7.
Если среда щелочная, то [H+]<10–7, а рН>7.
Ввиду большого практического значения величины рН среды разработано много методов его непосредственного определения. В настоящее время применяют колориметрический метод (по окрашиванию), основанный на изменении окраски индикаторов, а также электрометрические методы с помощью специальных приборов рН-метров.
Индикаторы
Вещества, изменяющие окраску при изменении реакции среды, - индикаторы – чаще всего сложные органические соединения – слабые кислоты или слабые основания. Схематично состав индикаторов можно выразить формулами НInd или IndOH, где Ind – сложный органический анион или катион индикатора.
Принцип применения индикаторов основан на том, что недиссоциированные молекулы индикатора и его Ind–ионы имеют в растворе разную окраску, и окраска раствора изменяется в зависимости от пложения равновесия диссоциации индикатора. Например, фенолфталеин (кислотный индикатор) имеет молекулы бесцветные, а анионы малиновые; метилоранж (основной индикатор) – желтые молекулы и красные катионы.
фенолфталеин метилоранж
HInd  H+ + Ind– IndOH
H+ + Ind– IndOH  Ind+ + OH–
Ind+ + OH–
бесцв. малинов. желт. красн.
Индикаторы, как слабые электролиты, имеют малые величины констант диссоциации. Например, Кд фенолфталеина равна 2∙10-10 и в нейтральных средах он находится преимущественно в виде своих молекул вследствие очень малой концентрации ионов, почему и остается бесцветным. При добавлении щелочи Н+-ионы фенолфталеина связываются, «стягиваются» с ОН–-ионами щелочи, образуя молекулы воды, и положение равновесия диссоциации индикатора смещается вправо – в сторону увеличения концентрации Ind–-ионов, появляется малиновое окрашивание. При добавлении в этот же раствор кислоты одновременно с нейтрализацией щелочи – при достаточной концентрации Н+-ионов – положение равновесия диссоциации индикатора смещается влево, в сторону моляризации, раствор снова обесцвечивается. Аналогично происходит изменение окраски метилоранжа: желтая в нейтральной среде переходит в красную в кислой среде при добавлении H+-ионов и снова в желтую при добавлении OH–-ионов.
Таким образом, окраска индикаторов зависит от рН-среды.
Раствор, содержащий индикатор, непрерывно изменяет свою окраску при изменении рН. Человеческий глаз, однако, не очень чувствителен к таким изменениям. Диапазон, в котором наблюдается изменение окраски индикатора, определяется физиологическими пределами восприятия цвета человеческим глазом. При нормальном зрении глаз способен различить присутствие одной окраски в смеси ее с другой окраской только при наличии как минимум некоторой пороговой плотности первой окраски: изменение окраски индикатора воспринимается только в той области, где имеется 5-10-кратный избыток одной формы по отношению к другой. Рассматривая в качестве примера HInd и характеризуя состояние равновесия
HInd  H+ + Ind–
H+ + Ind–
соответствующей константой
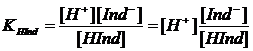 ,
,
можно написать, что индикатор проявляет свою чисто кислотную окраску, обычно улавливаемую наблюдателем, при
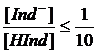 ,
,
а чисто щелочную окраску при
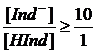 .
.
Внутри интервала, определяемого этими величинами, проявляется смешанная окраска индикатора.
Таким образом, глаз наблюдателя различает изменение окраски лишь при изменении реакции среды в интервале около 2-х единиц рН. Например, у фенолфталеина этот интервал рН от 8,2 до 10,5: при рН=8,2 глаз наблюдает начало появления розовой окраски, которая все усиливается до значения рН=10,5, а при рН=10,5 усиление красной окраски уже незаметно. Этот интервал значений рН, в котором глаз различает изменение окраски индикатора, называют интервалом перехода окраски индикатора.
Указанный диапазон рН величиной приблизительно в 2 единицы для различных индикаторов не приходится на одну и ту же область шкалы рН, так как его положение зависит от конкретного значения константы диссоциации каждого индикатора. В табл.4 приложения приведены интервалы перехода и цвета наиболее распространенных кислотно-основных индикаторов.
ЛАБОРАТОРНЫЕ РАБОТЫ ПО ТЕМЕ
«РАСТВОРЫ ЭЛЕКТРОЛИТОВ»
