Получение коллоидных растворов
Лабораторная работа №1
ПОЛУЧЕНИЕ КОЛЛОИДНЫХ РАСТВОРОВ
Реактивы и оборудование.
2 %-ный спиртовой раствор канифоли, 2 %-ный водный раствор FeCl3, 1,5 %-ный водный раствор KMnO4, 1 %-ный водный раствор Na2S2O3, 0,1 %-ный водный раствор K4[Fe(CN)6].
Градуированная пипетка 10 см3, мерная пипетка 1 см3, мерный цилиндр 100 см3, колба плоскодонная 250 см3, колба плоскодонная 100 см3, пробирка 15 см3, фильтровальная бумага, стеклянная палочка, штатив для пробирок.
Электрическая плитка.
4. Порядок выполнения работы.
Опыт 1. Золь канифоли.
2%-ный спиртовой раствор канифоли добавить по каплям при энергичном взбалтывании к 100 мл дистиллированной воды до получения беловатого, опалесцирующего золя.
Опыт 2. Золь гидроксида железа III.
100 мл дистиллированной воды нагреть до кипения. Затем в кипящую воду по каплям добавить 2%-ный раствора FeCl3 до получения прозрачного золя вишневого цвета.
Опыт 3. Золь диоксида марганца.
К 1 мл 1,5 % раствора KMnO4 в пробирке добавить 10 мл воды. По каплям из пипетки ввести 0,5 мл 1%-ного раствора Na2S2O3.
Опыт 4. Значение порядка сливания растворов реагентов для получения коллоидных растворов.
а) К 20 мл 0,1%-ного раствора K4[Fe(CN)6] прибавить при энергичном взбалтывании 5-6 капель 2%-ного раствора FeCl3.
б) К 20 мл 2%-ного FeCl3 прибавить при энергичном взбалтывании 5-6 капель 0,1%-ного раствора K4[Fe(CN)6].
Определение знака заряда коллоидных частиц. Знак заряда коллоидных частиц в окрашенных золях можно определить методом капиллярного анализа. Метод основан на том, что целлюлозные стенки капилляров фильтровальной бумаги заряжаются отрицательно, а пропитывающая бумагу вода положительно. Если на листок бумаги нанести каплю исследуемого золя, то частицы, заряженные положительно, адсорбируются на стенках капилляров, поэтому золь с положительными частицами дает окрашенное в центре и бесцветное по краям пятно. Золь с отрицательно заряженными частицами, не адсорбирующимися на стенках капилляров, образует равномерно окрашенное пятно.
Обработка экспериментальных данных.
Заполните таблицу № 1.1 «Экспериментальные данные и их анализ»:
Таблица №1.1 «Экспериментальные данные и их анализ»
| № опыта | Описание полученной коллоидной системы (Цвет, наличие осадка, устойчивость и т.п.) | Уравнение химической реакции или схема процесса получения золя | Знак заряда коллоидных частиц, определенный по методу капиллярного анализа | Формула мицеллы |
Выводы по работе.
1. Назовите изученные методы получения коллоидных систем.
2. Как влияет порядоксливания растворов реагентов на получение коллоидных растворов?
3. Отличается ли теоретический и экспериментальный знак заряда коллоидных частиц? Назовите причину.
Вопросы для контроля.
1. Какие системы называют дисперсными?
2. Параметры и признаки дисперсных систем.
3. По каким признакам классифицируют дисперсные системы?
4. Какими методами получают дисперсные системы?
5. Условия получения дисперсных систем.
6. Термодинамические условия получения дисперсных систем.
7. Типы коллоидных мицелл в растворах.
8. Строение мицеллы в лиофобном коллоидном растворе.
9. Чем ионы адсорбционного слоя отличаются от ионов диффузного слоя в мицелле?
10. Правило Панета-Фаянса.
11. Молекулярно-кинетические свойства дисперсных систем.
12. Электрокинетические свойства дисперсных систем.
13. Какими методами коллоидные системы очищают от примесей электролитов?
14. Какими методами можно подтвердить факт получения дисперсной системы?
15. Какими методами можно исследовать золи?
Лабораторная работа №2
КОАГУЛЯЦИЯ
Цели работы.
1. Определить порог коагуляции золя берлинской лазури под действием различных электролитов.
2. Проверить выполнимость правила Шульце – Гарди для данной системы.
Реактивы и оборудование.
Насыщенный раствор K4[Fe(CN)6], насыщенный раствор FeCl3, 2 %-ный раствор С2Н2О4, 1М раствор KCl, 0,5 М раствор AlCl3.
Градуированная пипетка 10 см3, градуированная пипетка 5 см3, колба плоскодонная 150см3, цилиндр мерный 100 см3, фильтровальная бумага, стеклянная палочка, пробирки 15 см3, штатив для пробирок.
Установка для фильтрования под пониженным давлением.
Порядок выполнения работы.
К 6 мл насыщенного раствора желтой кровяной соли K4[Fe(CN)6] добавить 3 мл насыщенного раствора FeCl3. Выпавший осадок перенести на воронку Бюхнера. После окончания фильтрации отсоединить воронку, отложить ее в кристаллизатор, колбу промыть дистиллированной водой, собрать снова фильтровальную установку Промыть на фильтре 2-3 мл 2% раствора щавелевой кислоты. Осадок быстро пептизируется, через фильтр проходит синий золь берлинской лазури, стабилизированный ионом оксалата. Полученный золь через фильтр разбавить водой до 100 мл.
Золь оставляют для дальнейшей работы и коагуляции.
Для определения порога коагуляции приготовить растворы электролитов с убывающей концентрацией. Концентрацию электролита в пробирке рассчитывать в соответствии с молярностью раствора и заданным объемом электролита по формуле
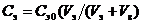 (2.1)
(2.1)
где Сэ – концентрация рабочего раствора электролита, моль/л;
Сэ0 – концентрация исходного раствора электролита, моль/л;
Vэ – объем раствора электролита в пробирке, мл;
Vв – объем воды в пробирке, мл.
Результаты расчета заносят в таблицу 2.1.
В каждую из пробирок добавить по 5 мл золя. Содержимое пробирок перемешать, встряхнуть и оставить для протекания процесса явной коагуляции.
Одновременно приготовить контрольный раствор. Для этого слить 5 мл исходного золя с 5 мл дистиллированной воды.
Сравнивая контрольный и исследуемый растворы, определить наличие или отсутствие коагуляции. Наличие коагуляции отметить знаком "+", отсутствие коагуляции – знаком "–". Расчет порога коагуляции провести по формуле
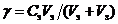 (2.2)
(2.2)
где γ – порог коагуляции, моль/л;
Сэ – молярность раствора электролита, моль/л;
Vэ – минимальный объем электролита, достаточный для коагуляции золя, мл;
Vз – объем золя, мл.
Выводы по работе.
1. Определите тип коагуляции.
2. Оцените влияние заряда иона-коагулятора на порог коагуляции, на коагулирующую способность иона.
3. Оцените влияние концентрации электролита на порог коагуляции, на коагулирующую способность.
4. Укажите причины коагуляции под действием электролитов, изменение в строении коллоидной частицы.
Вопросы для контроля.
. Причины возникновения двойного электрического слоя (ДЭС).
2. Как меняется величина потенциала в ДЭС?
3. Электрокинетический дзета (ξ)-потенциал.
4. Влияние индифферентных и неиндифферентных электролитов на ДЭС и ξ-потенциал.
5. Перезарядка коллоидных частиц неиндифферентными электролитами.
6. Перезарядка коллоидных частиц индифферентными электролитами.
7. Агрегативная устойчивость дисперсных систем. Коагуляция. Коалесценция.
8. Факторы стабилизации дисперсных систем.
9. Порог коагуляции. Коагулирующая способность.
10. «Медленная» и «быстрая» коагуляция.
11. Правило Шульце-Гарди.
12. Лиотропные ряды.
13. «Неправильные» ряды.
14. Основы теории ДЛФО.
15. Нейтрализационная и концентрационная коагуляция.
Лабораторная работа №3
Оптические свойства ЗОЛЕЙ
Цели работы
1. Изучить зависимость оптической плотности и светопропускания бесцветного золя от длины волны падающего света и концентрации золя.
2. Определить средний размер частиц и установить влияние концентрации золя на размер частиц.
Реактивы и оборудование
0,005 М раствор AgNO3, 0,005 М раствор KBr.
Мерная пипетка 10 см3, мерная пипетка 25 см3, мерный цилиндр 50 см3, мерная колба 50см3, колбы плоскодонные 100 см3.
Фотоэлектроколориметр с набором кювет.
Порядок выполнения работы
В плоскодонную колбу на 100 мл налить с помощью мерного цилиндра 40 мл 0,005 М раствора KBr и при сильном перемешивании добавить мерной пипеткой 10 мл 0,005 М раствора AgNO3. Образуется бесцветный золь бромида серебра (его концентрацию обозначить С).
Приготовить еще три золя на основе полученного методом двойного разбавления. Для этого необходимо мерной пипеткой набрать 25 мл золя, перенести в мерную колбу на 50 мл и довести дистиллированной водой до метки. Тщательно перемешать и перенести в плоскодонную колбу на 100 мл. Концентрацию полученного золя обозначить ½ С. Аналогичным способом получить золи с концентрацией ¼ С и 1/8 С.
В левую ячейку на все время измерений устанавливается кювета с дистиллированной водой, в правую – кювета с золем.
Произвести измерение на фотоколориметре со светофильтрами № 3¼8 (λ = 400¼750 нм) в соответствии с инструкцией к прибору.
Результаты эксперимента занести в таблицу 3.1
Таблица 3.1 «Экспериментальные и расчетные данные для определения размера частиц в бесцветном золе»
| Концентрация золя | Длина волны λ, нм | Оптическая плотность А | Светопропускание Т, % | Светорассеяние 100 – Т, % | lg А | lg λ | х | Диаметр частицы d, нм |
| С | ||||||||
| ½ С | ||||||||
| 1/4 С | ||||||||
Выводы по работе.
1. Проанализируйте полученные графические зависимости. Определите, как влияет длина волны на оптическую плотность и светорассеяние, как влияет концентрация золя на оптическую плотность. Сопоставьте полученные результаты с уравнениями Рэлея и Бугера-Ламберта-Бера.
2. По размеру частиц определите тип исследуемой дисперсной системы.
Вопросы для контроля.
1. Какие оптические свойства наблюдаются при падении луча света на золь?
2. В чем сущность опалесценции и эффекта Тиндаля?
3. Какое уравнение лежит в основе теории светорассеяния и каковы границы его применения?
4. Как влияет размер частиц на интенсивность светорассеяния?
5. Как влияет концентрация золя на интенсивность светорассеяния?
6. Что называют оптической плотностью и светопропусканием раствора?
7. Каково математическое выражение основного закона светопропускания Бугера-Ламберта-Бера и каковы границы его применения?
8. В какой форме применяют закон Бугера-Ламберта-Бера к окрашенным и бесцветным золям? Что такое мутность раствора?
9. Какой метод анализа называют турбидиметрией? Какой прибор используют для проведения анализа?
10. Почему оптическую плотность, измеренную для бесцветных золей, называют кажущейся?
11. В чем сущность нефелометрии? Какой прибор используют для проведения анализа?
12. Почему красный свет используют для сигнализации, а синий – для светомаскировки?
13. Почему небо голубое, а закат красный?
14. В чем различие явления опалесценции и флуоресценции?
15. Что такое полихромия золя?
Лабораторная работа № 4
Цели работы
1. Получить пену и определить ее основные характеристики.
2. Изучить влияние ПАВ, высокомолекулярных веществ и электролитов на ее устойчивость.
Реактивы и оборудование.
Поверхностно-активное вещество, 0,1 М раствор KCl, пеногаситель.
Пробирки с пробками 50 мл, мерная колба 50 мл, плоскодонные колбы 50 мл, мерная пипетка 25 мл, мерная пипетка 10 мл, градуированная пипетка 1 мл.
Секундомер, технохимические весы, линейка.
Порядок выполнения работы
Приготовить 50 мл водного раствора ПАВ из расчета 4 г ПАВ на 1 л раствора.
Рассчитать массу ПАВ. Взвесить и перенести в мерную колбу на 50 мл. Прибавить в колбу до половины объема теплую дистиллированную воду и перемешать до полного растворения ПАВ (при интенсивном перемешивании будет образовываться пена). Затем долить в колбу до метки дистиллированную воду и снова осторожно перемешать. Из полученного раствора ПАВ методом двойного разбавления приготовить еще 2 раствора ПАВ с концентрациями (г/л): 2; 1.
Отобрать по 10 мл каждого раствора и перенести в 3 одинаковых пробирки с пробками, измерьте высоту раствора hЖ.
Интенсивно встряхивать каждый цилиндр в течение 30 с (не менее 30 – 40 раз), затем пробки убрать.
Измерить линейкой высоту пены hП и высоту жидкости hЖП, находящейся в равновесии с пеной, сразу после встряхивания (начальный момент времени), а затем через 2 и 5 минут. Измерения делать сразу во всех цилиндрах. Обратить внимание на размер пузырьков пены.
В каждую пробирку добавить по 0,2 мл 0,1 М раствора KCl, растворы тщательно перемешать и повторить измерение характеристик пены.
Проверить действие пеногасителя на одной из пробирок.
Выводы по работе.
1. Назвать метод получения пены.
2. Указать, является пена монодисперсной или полидисперсной системой, используя данные визуального наблюдения.
3. Проанализировать полученные графические зависимости и определить, как изменяется высота пены с течением времени; как влияет концентрация ПАВ на высоту пены, кратность пены.
4. Оценить пенообразующую способность изучаемого ПАВ, сделать предположение о механизме его стабилизирующего действия.
5. Оценить влияние хлорида калия на пенообразующую способность ПАВ.
6. Описать действие пеногасителя.
Вопросы для контроля.
1. Поверхностно-активные, инактивные и неактивные вещества. Примеры.
2. Правило уравнивания полярностей (Ребиндер).
3. Пены и методы их получения.
4. Коалесценция
5. Изотермическая перегонка дисперсных систем.
6. Пенообразующая способность раствора. Кратность пены.
7. Устойчивость пены. Синерезис.
8. Роль ПАВ в образовании пен. Эффект Марангони.
9. Сравнение устойчивости жидких и твердых пен.
10. Механизмы разрушения пен.
11. Где используются пены? В каких случаях пенообразование нежелательно?
12. Пеногасители и антивспениватели.
13. Строение пен. Треугольник Плато.
14. Пенообразователи первого рода.
15. Пенообразователи второго рода.
Лабораторная работа № 5
АДСОРБЦИЯ
Цели работы.
1. Изучить адсорбцию различных веществ из растворов;
2. Построение изотермы адсорбции.
Реактивы и оборудование.
Активированный уголь, йодид калия, растворы уксусной кислоты концентрацией 0,05 н, 0,1 н, 0,2 н, фенолфталеин, 0,1 н раствор гидроксида натрия, сероводородная вода, раствор индиго, раствор йода, 0,5 %-ный раствор нитрата свинца.
Колбы плоскодонные 100 мл, колбы конические 100 мл, пипетка мерная 50 мл, пипетка мерная 10 мл, пробки для колб, воронки, фильтровальная бумага, бюретка 25 мл, химический стакан 50 мл, штатив для бюретки, штатив для пробирок, пробирки.
Технохимические весы, вибросмеситель.
Порядок выполнения работы.
Выводы по работе.
1. Сделать вывод о зависимости адсорбции от концентрации растворенных веществ.
2. Охарактеризовать активированный уголь как адсорбент на основании проведенных опытов.
Вопросы для контроля.
1. Адсорбция как самопроизвольный процесс.
2. Уравнение Гиббса. Для адсорбции каких веществ оно применимо?
3. Уравнение Шишковского. Влияние концентрации растворов ПАВ на поверхностное натяжение.
4. Правило Траубе, область применения.
5. Адсорбция на твердых адсорбентах. Уравнение Лэнгмюра.
6. Уравнение Фрейндлиха. В каких случаях оно используется? Определение констант уравнения Фрейндлиха.
7. Сформулируйте основные положения теории Ленгмюра и запишите уравнение изотермы адсорбции.
8. Проанализируйте уравнение Ленгмюра при а) c → ∞; б) c → 0; в) Г=Г∞/2. Чему равна константа k?
9. Пояснить термины «мономолекулярная адсорбция» и «полимолекулярная адсорбция».
10. Входят ли в теорию Поляни представления о локализованной адсорбции? Ответ обоснуйте.
11. Что такое адсорбционный объем, адсорбционный потенциал, характеристическая кривая?
12. Каковы основные положения теории БЭТ и ее практическое значение? Какую важнейшую характеристику адсорбента получают, пользуясь этой теорией?
13. В чем заключаются особенности адсорбции из растворов?
14. Будет ли отличаться ориентация молекул ПАВ при адсорбции из водных растворов на угле и силикагеле?
15. Смачивание. Краевый угол смачивания. Закон Юнга.
16. Растекание жидкости по поверхности другой жидкости. Эффект Марангони.
17. Адсорбционное понижение прочности. Применение в практических целях.
Лабораторная работа № 6
Цель работы.
1. Определить вискозиметрическим методом относительную вязкость растворов ВМВ различных концентраций.
2. Рассчитать удельную, приведенную и характеристическую вязкости.
3. Рассчитать молярную массу ВМВ.
Реактивы и оборудование.
1 % растворы желатина или крахмала.
Мерная колба 25 мл, плоскодонные колбы 50 мл, градуированная пипетка 10 мл, штатив
Вискозиметр Оствальда, секундомер.
Порядок выполнения работы.
Из исходного раствора ВМВ с концентрацией 1 % приготовить еще два раствора методом двойного разбавления.
Укрепить в штативе строго вертикально чистый, промытый дистиллированной водой вискозиметр. С помощью пипетки внести в широкое колено вискозиметра 10 мл дистиллированной воды. Затем грушей затянуть жидкость в узкое колено выше верхней метки и дать жидкости свободно течь. При прохождении уровня жидкости через верхнюю метку включить секундомер, при прохождении его через нижнюю метку – выключить. Определить время истечения t0 воды не менее трех раз. По результатам отсчетов рассчитать среднее значение времени tср истечения чистого растворителя – дистиллированной воды.
Вискозиметр ополоснуть наиболее разбавленным раствором ВМВ. Измерить время истечения t этого раствора не менее трех раз и рассчитать среднее значение времени истечения tср. Опыт повторить для всех растворов ВМВ. Переходя к более концентрированному раствору, тщательно ополаскивать вискозиметр. Полученные результаты внести в табл. 6.3.
Таблица 6.3
Экспериментальные данные по определению вязкости растворов ВМВ
| Концентрация раствора ВМВ ω, % | Время истечения t, с | tср | ηотн | ηуд | ηпр | ||
| 0,5 | |||||||
| 0,25 |
Выводы по работе.
1. Определите, как влияет концентрация ВМВ на величину относительной вязкости по данным табл. 6.3.
2. Проанализируйте полученное значение величины М (соответствует ли она молярным массам высокомолекулярных веществ).
Вопросы для контроля.
1. Какие вещества называют ВМВ?
2. Почему растворы ВМВ относят к коллоидным растворам?
3. Каковы особенности свойств растворов ВМВ?
4. В чем проявляются аномалии вязкости растворов ВМВ и каковы их причины?
5. Почему закон Ньютона, а также уравнения Пуазейля и Эйнштейна нельзя применять для определения вязкости ВМВ?
6. Какие виды вязкости используют?
7. Что характеризует уравнение Бингама?
8. Когда применяется понятие «структурная вязкость», или «пластическая вязкость»?
9. В чем сущность вискозиметрического метода определения молярной массы ВМВ?
10. В каких случаях для определения молярных масс ВМВ используют обычное уравнение Штаудингера, в каких – модифицированное уравнение Штаудингера?
11. Какие еще методы используют для определения молярной массы ВМВ?
Лабораторная работа № 7
Цель работы.
1. Изучить влияние рН на высаливание желатина.
2. Изучить влияние рН на мутность раствора желатина.
3. Определить изоэлектрическую точку желатина.
4. Изучить явление коллоидной защиты.
Реактивы и оборудование.
0,1 М раствор уксусной кислоты, 0,1 М раствор ацетата натрия, 1%-ный раствор желатина, насыщенный раствор сульфата аммония, 1%-ный раствор нитрата серебра, 0,1 М раствор соляной кислоты.
Градуированные пипетки 2 мл, градуированные пипетки 5 мл, пробирки, штатив для пробирок.
Секундомер.
Порядок выполнения работы.
Влияние рН на высаливание желатина. Определение изоэлектрической точки желатина по мутности его растворов (визуальный метод)
Приготовить буферные смеси в пяти пронумерованных пробирках, как указано в таблице 7.1
Таблица 7.1
Экспериментальные данные измерения степени мутности при высаливании желатина из растворов с различными рН
| № пробирки | V (0,1М CH3COOH), мл | V (0,1М CH3COONa), мл | рН | Степень мутности |
| 1,8 | 0,2 | 3,8 | ||
| 1,4 | 0,6 | 4,4 | ||
| 1,0 | 1,0 | 4,7 | ||
| 0,6 | 1,4 | 5,1 | ||
| 0,2 | 1,8 | 5,7 |
В каждую пробирку добавить 1 мл 1%-ного раствора желатина, затем по 1 мл «высаливающего» агента: насыщенного раствора (NH4)2SO4, растворы перемешать.
Через 5 минут после добавления сульфата аммония отметить степень мутности по 5-балльной шкале. Определить значение ИЭТ желатина.
Коллоидная защита
Взять две пробирки и налить в каждую по 1 мл раствора AgNO3. В одну из пробирок добавить 1 мл золя желатина, перемешать. Затем в обе пробирки прибавить по 1 мл раствора соляной кислоты, перемешать. Описать наблюдаемые явления.
Выводы по работе.
1. Оценить, как влияет величина рН на способность к высаливанию желатина из растворов.
2. Сравнить экспериментальное и теоретическое значение ИЭТ желатина.
3. Объяснить влияние желатина на величину дзета-потенциала образующегося золя AgCl и его стабилизирующее действие.
Вопросы для контроля.
1. Какие дисперсные системы называют лиофильными?
2. Каковы особенности растворения ВМВ?
3. Чем обусловлена агрегативная устойчивость растворов ВМВ?
4. Что такое высаливание и какие факторы влияют на процесс высаливания?
5. Что такое студень и как его получают?
6. Какой процесс называется набуханием? Каков механизм набухания?
7. Как изменяются энергия Гиббса, энтальпия и энтропия в процессе набухания?
8. Каковы количественные характеристики процесса набухания?
9. Какие факторы влияют на процесс набухания?
10. Какие факторы влияют на процесс застудневания растворов ВМВ?
11. Какие ВМВ называют полиэлектролитами, полиамфолитами?
12. Что такое изоэлектрическое состояние ВМВ, изоэлектрическая точка белков?
13. Как изменяется форма макромолекул белков в кислой и щелочной средах?
14. Какие свойства белков изменяются в ИЭТ?
15. Какие методы используют для определения ИЭТ белков?
Лабораторная работа №1
ПОЛУЧЕНИЕ КОЛЛОИДНЫХ РАСТВОРОВ
