При нашем способе расположения электронов отпадает необходимость в теории гибридизации орбиталей (да и вообще в самих орбиталях).
Становится понятной причина равноценности всех химических связей и симметричность расположения их относительно центра у таких молекул как CH4, BF3 , BeCl2 . Так же легко объясняются явления пространственной изомерии и аллотропии.
Вы мне можете возразить, что такая конфигурация электронов будет достаточно неустойчивой. Согласен. Но напомню вам, что между ядром и электронами действуют, кроме электрических, ещё и гравитационные силы. Вот именно они и ответственны за появление потенциальной ямы, в которой находятся электроны. По величине энергии ионизации атома можно понять, насколько глубока эта яма. 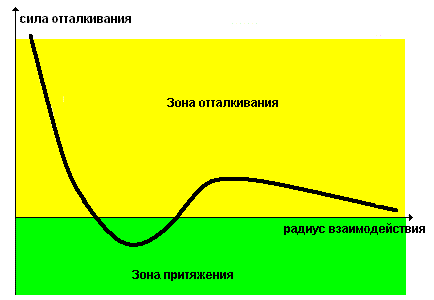
Замечу, что расстояние от электрона до ядра можно найти используя равенство между собой двух сил. Силы электрического притяжения между ядром и электроном и силы электрического отталкивания между одним электроном и всеми остальными, составляющими электронную оболочку.
Откуда берётся деление химических элементов по периодам?
Два электрона располагаясь центрально симметрично относительно ядра, занимают всю сферическую область и третий электрон вынужден располагаться уже дальше от ядра. Так продолжается до тех пор, пока вся сферическая область следующего уровня не будет заполнена. Так как расстояние от ядра становится больше, то такая область может вместить уже восемь электронов. Свою роль в этом играет и возросший положительный заряд ядра.
Новая теория химической связи, вытекающая непосредственно из устройства атомов
Очевидны всего два возможных способа образования молекул. Но, что очень важно. Оба способа объединения атомов становятся возможны лишь при наличии вакансий в электронной оболочке реагентов. Вакансии есть во всех атомах, кроме инертных газов, скажете вы. Почему же не объединяются в молекулу, допустим два атома бериллия. Напомню, что мы во всём опираемся на принцип непрерывности, из которого следует, что уж если вакансии начали заполняться, то процесс должен закончиться лишь при заполнении всех имеющихся вакансий. Так происходит, например с двумя атомами кислорода.
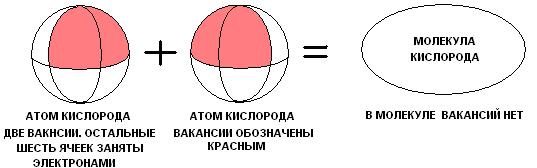
Рисунок даёт представление об одном из возможных видов химической связи. Так и будем для простоты называть её вакантной связью (В-В).
Второй вид химической связи возникает в случае, когда у одного из реагентов слишком большая вакантная область. Тогда происходит следующее. Электроны этого реагента будут представлять своего рода возвышенности на теле атома, назовём для краткости их пиками (показаны на рисунке синим цветом). Так вот эти пики при химической реакции будут заполнять вакантные области второго реагирующего атома. И конечно, по принципу непрерывности, должны будут заполнить все имеющиеся вакансии.
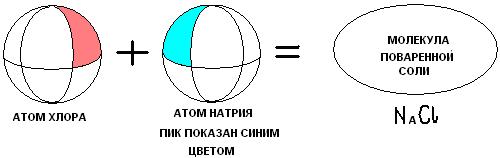
Назовём такую связь вакантно-пиковой (В-П).
