Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем.
Положение химического равновесия зависит от следующих парамктров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1884 году французским ученым Ле-Шателье. Современная формулировка принципа Ле-Шателье такова:
| Если на систему,находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдет в другое состояние так, чтобы уменьшить эффект внешнего воздействия. |
1. Влияние температуры. В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое - эндотермическому.
N2 + 3H2  2NH3 + Q 2NH3 + Q |
Прямая реакция - экзотермическая, а обратная реакция - эндотермическая. Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам:
| При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры - в направлении экзотермической реакции. |
2. Влияние давления.Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переоходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам:
| При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом; при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом |
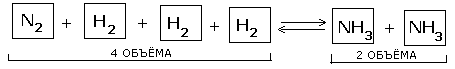
Таким образом, при переходе от исходных веществ к продуктам объем газов уменьшился вдвое. Значит, при повышении давления равновесие смещается в сторону образования NH3, о чем свидетельствуют следующие данные для реакции синтеза аммиака при 400 0С:
| давление, МПа | 0,1 | |||||
| объемная доля NH3, % | 0,4 |
3. Влияние концентрации.Влияние концентрации на состояние равновесия подчиняется следующим правилам:
| При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции; при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ. |
14. Растворы. Типы растворов. Способы выражения состава растворов.
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов).
По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми.Обычно компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор, считают растворителем, остальные составляющие раствора – растворенными веществами. В случае одинакового агрегатного состояния компонентов растворителем считают тот компонент, который преобладает в растворе.
В зависимости от размеров частиц растворы делятся на истинные и коллоидные. В истинных растворах (часто называемых просто растворами) растворенное вещество диспергировано до атомного или молекулярного уровня, частицы растворенного вещества не видимы ни визуально, ни под микроскопом, свободно передвигаются в среде растворителя. Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени.
Коллоидные растворы - это высокодисперсные двухфазные системы, состоящие из дисперсионной среды и дисперсной фазы, причем линейные размеры частиц последней лежат в пределах от 1 до 100 нм. Как видно, коллоидные растворы по размерам частиц являются промежуточными между истинными растворами и суспензиями и эмульсиями
•Способы выражения состава раствора
В химии для количественного выражения состава растворов чаще всего используют массовую долю, молярную концентрацию (молярность) и эквивалентную концентрацию (нормальность). Существуют также моляльная концентрация (моляльность), мольная доля, а также массовая концентрация и объемная концентрация (табл. 1).
Способы выражения концентрации растворов
Наименование и обозначение Расчетная формула* и размерность
-Массовая доля w
w = mB / mP = = mB / (mB + ms) [доли от 1 или %]
-Объемная доля (для газов) vi
vi = VB / V [доли от 1 или %]
-Мольная доля µi µi = nB / (nB + ns) [доли от 1]
-Массовая концентрация B B = mB / Vs [г / л]
-Молярная концентрация сB (молярность) сB = nB / V [моль / л]
-Эквивалентная концентрация сeq (нормальность) сeq = neq / V = (z nB) / V [моль экв. / л]
-Моляльная концентрация mi (моляльность) mi = nB / ms [моль / кг]
* Условные обозначения: mB - масса растворенного вещества; ms - масса растворителя, mр - масса раствора; nB - количество растворенного вещества (моль); neq - эквивалентное количество растворенного вещества (моль эквивалентов); ns - количество растворителя (моль); V - объем раствора; VB - объем растворенного вещества (газообразного); z- эквивалентное число
Под концентрацией раствора химики подразумевают, прежде всего, молярность раствора (т.е. количество растворенного вещества nB в моль, отнесенное к общему объему раствора в л). Единица измерения молярной концентрации сB - моль/л.
Если в растворе серной кислоты H2SO4 молярная концентрация равна 1 моль/л, то это обозначается как 1М раствор H2SO4 (одномолярный раствор серной кислоты).
Молярность раствора рассчитывается по данным о его приготовлении или по результатам химического анализа, позволяющим судить о содержании растворенного вещества в некотором объеме раствора.
15. Свойства растворов неэлектролитов. Законы Рауля и Вант-Гоффа
РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ - бинарные или многокомпонентные молекулярные системы, состав которых может изменяться непрерывным образом (по крайней мере, в некоторых пределах). В отличие от растворов электролитов, в растворах неэлектролитов заряженные частицы в сколько-нибудь заметных концентрациях отсутствуют.
Значительное влияние на физические свойства растворов (в частности, на рассеяние света) оказывают флуктуации плотности, концентрации, ориентации молекул. Роль флуктуации концентрации особенно велика вблизи критической точки растворимости.
Поскольку образование р-ра при смешении жидкостей - самопроизвольный процесс, то Gm < 0.
Растворы неэлектролитов– частицы, плохо растворимые в воде, так как нет носителя электрического заряда. Закон Рауля справедлив только для разбавленных растворов неэлектролитов.
Пусть PBO – давление пара над чистым растворителем, при постоянной температуре T1; PB– давление пара растворителя при этой же температуре, но над раствором, состоящим из нелетучего компонента А (сахар), и чистым жидким растворителем В:
PB = f (T).
Разность PBO – PB равна понижению давления пара.
Величина (PBO – PB) /PBO – относительное понижение упругости пара = XA = ?P/PBO, гдеXA – мольная доля, PBO > PB, ?P = PBO – PB – абсолютное понижение упругости пара.
Закон Рауля.Относительное понижение упругости пара растворителя над раствором равно мольной доле растворенного нелетучего компонента.
Следствия из закона Рауля:
1. Растворение нелетучего компонента в растворителе приводит к расширению температурной области существования жидкой фазы.
2. Понижение температуры замерзания и повышение температуры кипения прямо пропорциональны моляльной концентрации растворенного вещества.
3. Растворы, содержащие одинаковое число молей растворенных веществ в одинаковых молях растворителя, обнаруживают одно и то же понижение температуры замерзания и одно и то же повышение температуры кипения.
закон Вант-Гоффа: осмотическое давление разбавленного раствора равно тому газовому давлению, которое производило бы растворенное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объем, равный объему раствора. Для количественной оценки характеристики осмотического давления Вант-Гофф воспользовался
уравнением газового состояния pV=nRT: πосмV=nRT 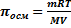
Законы Вант-Гоффа и Рауля установлены эмпирически для разбавленных растворов неэлектролитов. При изучении растворов электролитов ( кислот, щелочей, солей) обнаружилось, что эти вещества вызывают более высокое осмотическое давление, чем это следует по закону Вант-Гоффа для неэлектролитов. Растворы электролитов замерзают при температурах более низких и кипят при температурах более высоких, чем одинаковые с ними по молекулярной концентрации растворы неэлектролитов. Для электролитов Я. Г. Вант-Гофф ввел поправочный множитель i, называемый изотоническим коэффициентом, который показывает, во сколько раз наблюдаемое осмотическое давление роп раствора больше вычисленного Рвыч.
Законы Вант-Гоффа и Рауля выведены для разбавленных растворов неэлектролитов. При изучении растворов электролитов ( кислот, щелочей, солей) обнаружилось, что эти вещества вызывают более высокое осмотическое давление, чем это следует по закону Вант-Гоффа для неэлектролитов. Это отражается и на других свойствах растворов: растворы электролитов замерзают при температурах более низких и кипят при температурах более высоких, чем одинаковые с ними по молекулярной концентрации растворы неэлектролитов. Следовательно, электролиты в растворе в отношении осмотического давления ведут себя так, как будто они содержат больше частиц, чем это соответствует числу молекул растворенного вещества.
Законы Вант-Гоффа и Рауля справедливы для идеальных растворов, в которых не происходит химическое взаимодействие между компонентами раствора, а также диссоциация или ассоциация молекул растворенного вещества. Однако опыт показывает, что не все растворы подчиняются этим законам. Установлено, что растворы, которые способны проводить электрический ток (электролиты), имеют более высокое, чем по закону Вант-Гоффа, осмотическое давление. Эти растворы кипят при более высокой температуре и замерзают при более низкой, чем это следует из закона Рауля. Такими свойствами обладают растворы солей, кислот и оснований.
16. . Свойства растворов электролитов. Степень диссоциации. Сильные и слабые электролиты. Константа диссоциации слабых электролитов. Ступенчатая диссоциация.
Свойства растворов электролитов определяют механизм, скорость и характер коррозии. Основные из этих свойств - концентрация (минерализация), проводимость, рН, степень диссоциации, диффузионные характеристики.
Свойства растворов электролитов представляется естественным разделить на две группы: 1) свойства, определяемые путем изучения равновесных систем, 2) свойства, определяемые путем изучения систем, находящихся в неравновесных состояниях. К первой группе принадлежат те свойства, которые могут быть найдены в результате определений понижения давления пара, повышения температуры кипения, понижения температуры замерзания, растворимости, теплоемкости, теплосодержания, потенциалов гальванических элементов и поверхностного натяжения. Ко второй группе относятся те свойства, которые могут быть найдены путем определений диффузии, электропроводности вязкости.
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
"Степень диссоциации это есть отношения числа продиссоциируемых молекул к общему числу молекул и умноженному на 100%":
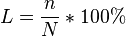
числа распавшихся на ионы молекул к общему числу растворенных молекул.
Степень диссоциации 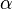 равна отношению числа диссоциированных молекул
равна отношению числа диссоциированных молекул 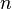 к сумме
к сумме 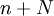 , где
, где 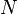 — число недиссоциированных молекул. Часто
— число недиссоциированных молекул. Часто 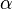 выражают в процентах. Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
выражают в процентах. Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы независимо от их концентрации в растворе.
Поэтому в уравнениях диссоциации сильных электролитов ставят знак равенства (=).
К сильным электролитам относятся:
- растворимые соли;
- многие неорганические кислоты: HNO3, H2SO4, HCl, HBr, HI;
- основания, образованные щелочными металлами (LiOH, NaOH, KOH и т.д.) и щелочно-земельными металлами (Ca(OH)2, Sr(OH)2, Ba(OH)2).
Слабые электролиты в водных растворах лишь частично (обратимо) диссоциируют на ионы.
Поэтому в уравнениях диссоциации слабых электролитов ставят знак обратимости (⇄).
К слабым электролитам относятся:
- почти все органические кислоты и вода;
- некоторые неорганические кислоты: H2S, H3PO4, H2CO3, HNO2, H2SiO3 и др.;
- нерастворимые гидроксиды металлов: Mg(OH)2, Fe(OH)2, Zn(OH)2 и др.
Константа диссоциации слабого электролита- величина постоянная и практически не зависит от концентрации раствора, а зависит только от температуры: Степень же диссоциации зависит от концентрации и от присутствия в растворе электролитов с одноименным ионом.
константа равновесия − константа диссоциации Kд выражается как
KA ↔ K+ + A−,
где:
- KA — недиссоциированное соединение;
- K+ — катион;
- A− — анион.
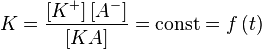
Чем больше значение K, тем сильнее данный электролит.
Ступенчатая диссоциация обусловливает возможность образования кислых и основных солей.
Для ступенчатой диссоциации всегда KI>KII>KIII>..., т.к. энергия, которую необходимо затратить для отрыва иона, минимальна при отрыве его от нейтральной молекулы.
Для многооснoвных кислот (например, H2CO3 или H3PO4) и многокислотных оснований типа Ca(OH)2 и La(OH)3 идет ступенчатая диссоциация - последовательный отрыв каждого катиона H+ или аниона OH-:
H2CO3 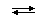 H+ + HCO3-,
H+ + HCO3-,
HCO3- 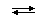 H+ + CO32-
H+ + CO32-
Ca(OH)2 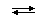 CaOH+ + OH-,
CaOH+ + OH-,
CaOH+ 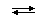 Ca2+ + OH-
Ca2+ + OH-
В этих случаях получался набор значений KД (для кислот KДК1, KДК2 …, для оснований - KДО1, KДО2 …), и сравнение кислот либо оснований по силе становилось неопределенным.
Ступенчатая диссоциация характеризуется тем, что распад электролита на каждой последующей ступени происходит в меньшей степени, чем на предыдущей. Такой характер изменения констант диссоциации можно объяснить электростатическим притяжением на основе закона Кулона. Энергия ионизации минимальна, когда ион отрывается от нейтральной молекулы электролита. Отрыв иона на каждой следующей ступени диссоциации требует возрастающей энергии, так как удаление иона происходит от частицы, заряд которой на последующих ступенях становится больше.
17. Гидролиз солей. Случаи обратимого и необратимого гидролиза. Ступенчатый гидролиз. Примеры. Степень гидролиза.
Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов.
Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
Различают обратимый и необратимый гидролиз солей[1]:
1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
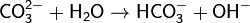
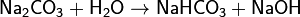
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
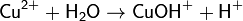
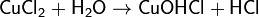
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
3. Гидролиз соли слабой кислоты и слабого основания:
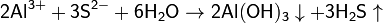
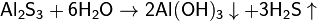
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
4. Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален (не обратимый гидролиз)
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Если соль содержит однозарядный катион (анион) и многозарядный анион (катион), то возможен ступенчатый гидролиз. Образующиеся в результате гидролиза по первой ступени по аниону кислые соли могут подвергаться дальнейшему взаимодействию с водой. Однако вторая и последующая ступени гидролиза выражены менее сильно. Это обусловлено изменением величин констант диссоциации соответствующих электролитов.
Например, поскольку ион 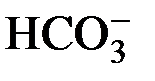 диссоциирует слабее, чем Н2СО3, то он образуется, в первую очередь, при гидролизе карбоната натрия (Na2CO3):
диссоциирует слабее, чем Н2СО3, то он образуется, в первую очередь, при гидролизе карбоната натрия (Na2CO3):
I ступень: Na2CO3 + Н2О D NaНСО3 + NaOH,
II ступень: NaНСО3+ Н2О DNaOH + H2CO3.
Гидролиз солей слабых многоосновных кислот по второй и третьей ступеням протекает мало и содержание в растворе продуктов гидролиза по этим ступеням незначительно и их можно не учитывать в расчетах.
18. . Ионное произведение воды и водородный показатель (рН) среды. Кислотно-основные индикаторы. Примеры.
Ио́нноепроизведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водныхрастворах.
Водоро́дныйпоказа́тель, pH — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичныйлогарифм активности водородных ионов, выраженной в молях на один литр:
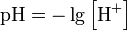
Кислотно-основные индикаторы — органические соединения, способные изменять цвет в растворе при изменении кислотности (pH). Например, метилоранж в кислой-красный, в щелочной-желтый, в нейтральной-оранжевый; лакмус в кислой среде-розовый, в щелочной-синий и нейтральной-фиолетовый.
19. Произведение растворимости. Условие выпадения осадка из растворов.
Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворепри постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
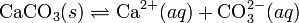
Константа этого равновесия рассчитывается по уравнению:
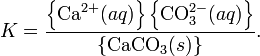
В приближении идеального раствора с учётом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:
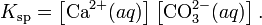
Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m катионов An+ и n анионов Bm-, рассчитывается по уравнению:
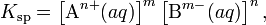
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
В растворе малорастворимого сильного электролита устанавливается равновесие между осадком (твердой фазой) электролита и ионами электролита в растворе, например:
BaSO4(осадок) <=> Ba2+ (раствор) + SO42- (раствор)
Поскольку в растворах электролитов состояние ионов определяется их активностями, то константа равновесия последнего процесса выразится следующим уравнением:
K = aBa2+ · aSO42- / aBaSO4
Так как активность твердого сульфата бария, есть величина постоянная, то и произведение активностей ионов также представляет собой постоянную величину.
При увеличении концентрации одного из ионов электролита в его насыщенном растворе (например, путем введения другого электролита, содержащего тот же ион) произведение концентраций ионов электролита становится больше ПР. При этом равновесие между твердой фазой и раствором смещается в сторону образования осадка. Таким образом, условием образования осадка является превышение произведения концентраций ионов малорастворимого электролита над его произведением растворимости. В результате образования осадка концентрация другого иона, входящего в состав электролита, тоже изменяется. Устанавливается новое равновесие, при котором произведение концентраций ионов электролита вновь становится равным ПР. Напротив, растворение осадка малорастворимого электролита происходит при условии, что произведение концентраций его ионов меньше значения ПР. Добавление в раствор электролита, не имеющего общих ионов с малорастворимым, приводит к увеличению растворимости малорастворимого электролита за счет увеличения ионой силы раствора (так называемый солевой эффект).
Из величины ПР вытекают условия образования и растворения осадков.
Образование осадка происходит, если:
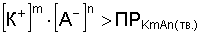 .
.
Это достигается прибавлением избытка электролита, содержащего одноименный ион K+ или A-.
Например, если в раствор малорастворимого электролита СаСО3 внести хорошо растворимый сильный электролит Nа2СО3, то повысится концентрация иона CO 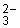 и понизится концентрация иона Ca2+ и следовательно, снизится растворимость СаСО3, таким путем можно осаждать малорастворимые соединения.
и понизится концентрация иона Ca2+ и следовательно, снизится растворимость СаСО3, таким путем можно осаждать малорастворимые соединения.
Растворение осадкапроисходит, если:
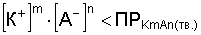 .
.
Это происходит, если связывается один из ионов, посылаемых осадком в раствор.
Например, растворение электролита  происходит при добавлении раствора соляной кислоты
происходит при добавлении раствора соляной кислоты  . Ионы водорода связывают ионыS2– в молекулы
. Ионы водорода связывают ионыS2– в молекулы 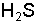 , которые удаляются в виде газа. Произведение концентрации ионов
, которые удаляются в виде газа. Произведение концентрации ионов 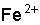 и
и 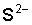 становится меньше произведения растворимости сульфида железа, и осадок растворяется.
становится меньше произведения растворимости сульфида железа, и осадок растворяется.
Зная величину ПР, можно регулировать образование или растворение осадка, также оценить выпадает ли в данных условиях осадок. Для этого концентрацию ионов подставляют в выражение:
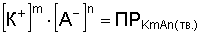
и полученную величину сравнивают со справочной. Осадок выпадет, если полученная величина ПР превышает табличную.
20.Окислительно-восстановительные реакции. Понятие о степени окисления. Окислители и восстановители. Окислительно-восстановительная двойственность. Примеры.!!!
К ОВР относят химический реакции, сопровождающиеся изменением степени окисления атомов одного или нескольких элементов, входящих в состав реагирующих веществ.
Под степенью окисления понимают заряд атома элементов соединения, вычисленный исходя из допущения, что молекула состоит только из ионов. Степень окисления – это понятие условное, т.к. большинство соединений не являются ионами это понятие введено для характеристики состояния атомов в молекулеи оно является полезным и удобным при классификации различных веществ и при составлении уравнений ОВР.
Для определения степени окисления атомов элементов в свободном состоянии и в химических соединениях следует придерживаться следующих правил:
1.Степени окисленности элементов в простых веществах принимаются равным 0.
2. Алгебраическая сумма степеней окисленности всех атомов, входящих в состав молекулы,равна нулю.
3. Постоянную степень окисления в соединениях проявляют щелочные металлы (+1), металлы главной подгруппы 2 группы, цинк и кадмий (+2).
4. У водорода степень окисленности (+1) во всех соединениях, кроме гидридов металлов (NaH,CaH2 и т.п.), где его степень окисленности равна (-1).
5. Степень окисленности кислорода в соединениях равна (-2), за исключением пероксидов (-1) и фторида кислорода OF2 (+2).
21. Классификация ОВР. Примеры.
Классификация ОВР
1. Реакции межмолекулярного восстановления-окисления
0 +5 +2 +2
Cu + HNO3 = Cu(NO3)2 + NO + H2O
2. Реакции диспропорционирования (самоокисление,самовосстановления)
+3 +5 +2
HNO2 = HNO3 + NO + H2O
3.Реакции внутри молекулярного окисления-восстановления
+5 –1 0
KClO3 = KCl + O2
22. Влияние условий на протекание ОВР. Составление уравнений ОВР. Метод электронного баланса . ионно-электронный метод . примеры !!!!
Влияние условий на протекание ОВР
На окислительную или восстановительную активность веществ влияет несколько факторов. Это и природа веществ и условия проведения, такие как температура
концентрация, реакция среды. Для примера рассмотрим влияние реакции среды на окислительные свойства пермаганата калия. KMnO4 является типичным окислителем, поэтому в ОВР он восстанавливается, а вот продукты восстановления зависят от pH среды.
pH<7 (кислая) 2KMnO4 +5KNO2 +3H2SO4=2MnSO4+5KNO3+K2SO4+3H2O
(малинов) (бесцвет)
PH=7(нейтральная) 2KMnO4+3KNO2+H2SO4 = 2MnO2+ 3KNO3+2KOH
(малинов) (бурый)
pH>7 (щелочная) 2KMnO4+ KNO3+ 2KOH = 2KMnO4+KNO3+H2O
(малинов) (зеленый)
Таким образом, с увеличением pH среды уменьшается окислительная способность KMnO4.
Составление уравнение ОВР
При составлении ур-ий ОВР используют 2 метода:
1. Метод электронного баланса. Он основан на использовании степени окисления. Это универсальный метод и может быть использован для уравнивания любой ОВР.
2. Метод ионно-электронного баланса или метод полуреакций. Основан на составлении ионной схемы реакции, при этом используются реальные частицы и их заряды. Метод полуреакции рекомендуется использовать для ОВР, протекающих в растворах.
Порядок действий при подборе коэффициентов методом полуреакций:
1. Записывают схему реакции в молекулярной и ионно-молекулярной формах и определяют ионы и молекулы, которые изменяют степень окисления.
2. Определяют среду, в которой протекает реакция (Н+ - кислая; ОН- - щелочная; Н2О – нейтральная)
3. Составляют ионно-молекулярное уравнение каждой полуреакции и уравнивают число атомов всех элементов.
- Количество атомов кислорода уравнивают, используя молекулы воды или ионы ОН-.
- Если исходный ион или молекула содержат больше атомов кислорода, чем продукт реакции, то
· избыток атомов кислорода в кислой среде связывается ионами Н+ в молекулы воды
· в нейтральной и щелочной среде избыток атомов кислорода связывают молекулами воды в группы ОН-
- Если исходный ион или молекула содержит меньшее число атомов кислорода, чем продукт реакции, то
· недостаток атомов кислорода в кислых и нейтральных растворах компенсируется за счёт молекул воды
· в щелочных растворах – за счёт ионов ОН-.
4. Составляют электронно-ионные уравнения полуреакций.
Для этого в левую часть каждой полуреакции добавляют (или вычитают) электроны с таким расчётом, чтобы суммарный заряд в левой и правой частях уравнений стал одинаковым. Умножаем полученные уравнения на наименьшие множители, для баланса по электронам.
5. Суммируют полученные электронно-ионные уравнения. Сокращают подобные члены и получают ионно-молекулярное уравнение ОВР
6. По полученному ионно-молекулярному уравнению составляют молекулярное уравнение.
Пример:
1. Na2SO3+KMnO4+H2SO4→Na2SO4+MnSO4+K2SO4+H2O
2Na++SO32-+K++MnO4-+2H++SO42-→2Na++SO42-+Mn2++SO42-+2K++SO42-+H2O
SO32- → SO42-
MnO4-→ Mn2+
2. Среда кислая – Н+
3.
MnO4- + 8 H+→ Mn2+ + 4 H2O
SO32- + H2O → SO42- + 2 H+
4.
MnO4- + 8 H+ + 5ē → Mn2+ + 4 H2O │*2
SO32- + H2O - 2ē → SO42- + 2 H+ │*5
5.
2MnO4- + 16 H+ + 10ē → 2Mn2+ + 8 H2O
5SO32- + 5H2O - 10ē → 5SO42- + 10 H+
2MnO4- + 16 H++ 5SO32- + 5H2O → 2Mn2+ + 8 H2O + 5SO42- + 10 H+
2MnO4- + 6 H++ 5SO32- → 2Mn2+ + 3 H2O + 5SO42-
6. 5Na2SO3+2KMnO4+3H2SO4→5Na2SO4+2MnSO4+K2SO4+3H2O
23. . Понятие об электродных потенциалах , механизм его возникновения. Стандартные электродные потенциалы. Уравнение Нернста.
Количественной характеристикой окислительно-восстановительных веществ, находящихся в растворах или соприкасающихся с ними, являются окислительно-восстановительные или электродные потенциалы.
В общем случае величина электродного потенциала зависит от:
1. Природы веществ, участвующих в электродном процессе
2. Соотношения концентраций окислительной и восстановительной форм этих веществ
3. Температуры
4. Природы растворителя
5. pH среды
Зависимость значения электродного потенциала от всех перечисленных факторов описывается уравнением Нерста:
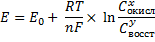
E- потенциал при данных условиях
Е0-стандартный потенциал, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии измеренный при Т=298К=25С, при давлении для газообразных в-в 101,3 кПа и концентрацией 1 моль/л
R-унив. газ. пост., Т температура в К, n-число электронов, принимающих участие в данном процессе, F- постоянная Фарадея, x,y- коэффициенты
Уравнение Нерста для металлического электрода
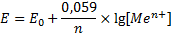
Механизм возникновения электродных потенциалов, их количественное определение, процессы, которые сопровождаются возникновением электрического тока или вызваны электрическим током, изучаются особым разделом химии – электрохимией.
К электрохимическим относятся явления, возникающие на границе двух фаз с участием заряженных частиц (ионов и электронов), например, при погружении металлической пластинки в воду.
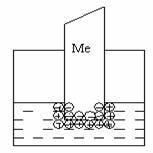
Для всех металлов характерно свойство в большей или меньшей степени растворяться в воде. При этом в воду переходят положительно заряженные ионы металла, в результате чего пластинка (из-за появления в ней избыточных электронов) заряжается отрицательно. Гидратированные катионы металла скапливаются возле поверхности пластинки на границе раздела двух фаз (металл-раствор). Возникает двойной электрический слой, характеризующийся некоторой разностью электростатических потенциалов. Как известно, энергию, которую необходимо затратить (положительный потенциал) или которую можно получить (отрицательный потенциал) при переносе единицы электричества из бесконечности в данную точку, называют электрическим потенциалом. Между пластинкой и раствором устанавливается окислительно-восстановительное равновесие:
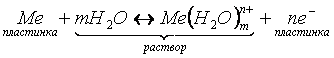 . (9.1)
. (9.1)
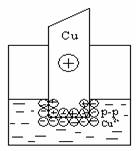
При погружении металла в раствор его соли также возникает двойной
электрический слой, но в этом случае возможны два механизма его образования. Если концентрация катионов металла в растворе мала или металл довольно активный, вследствие чего равновесие процесса, указанного выше, сдвинуто вправо, то металлическая пластинка заряжается отрицательно:
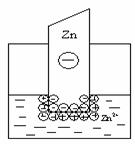
В том случае, когда концентрация катионов металла в растворе велика или металл малоактивный, равновесие указанного процесса сдвигается влево и металлическая пластинка заряжается положительно:
В любом случае на границе раздела двух фаз образуется двойной электрический слой. Разность (скачок) потенциалов, возникающая между металлом и жидкой фазой, называется электродным потенциалом Е. Потенциалу металла приписывается тот знак, который возникает на его поверхности в двойном электрическом слое.
Пластинка металла и раствор его соли (т.е. катионы этого металла) вместе составляют единую окислительно-восстановительную систему, характеризующуюся определенным электродным потенциалом, который зависит от природы металла, концентрации его ионов в растворе, от температуры и рН среды.
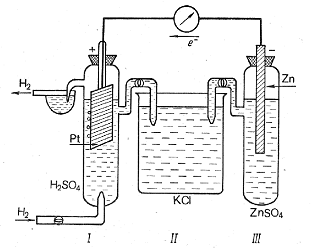
При определении скачка потенциала в окислительно-восстановительных системах, не содержащих твердой фазы (например, MnO4-/Mn2+ или Cr2O72-/Cr3+), используют инертные электроды (благородные металлы, графит). В этом случае инертные электроды, адсорбируя из раствора молекулы, атомы или ионы, играют роль твердой фазы, обеспечивающей возникновение скачка потенциалов на межфазной границе.
Экспериментально определить абсолютное значение электродного потенциала невозможно. Поэтому на практике измеряется разность потенциалов между электродным потенциалом исследуемой системы и потенциалом электрода сравнения. В качестве стандартного электрода сравнения обычно используют водородный электрод. Он изготавливается из губчатой платины, погруженной в раствор H2SO4 c активностью ионов водорода, равной единице (что соответствует примерно их концентрации, равной 1 моль/л). Через раствор при 298 К (25 оС) под давлением в 101,325 кПа пропускается газообразный водород, который поглощается губчатой плат
