Физико-химические свойства и структура воды.
Основные физико-химические свойства воды влияют на все процессы, в которых вода принимает участие.
1.Поверхностное натяжение - это степень сцепления молекул воды друг с другом. Вода в организме играет роль растворителя, обеспечивает транспортную систему и служит средой обитания наших клеток. Поэтому, чем ниже поверхностное натяжение, соответственно, выше растворяющая способность воды, тем лучше вода выполняет свои основные функции.
2. Кислотно-щелочное равновесие воды. Основные жизненные среды (кровь, лимфа, слюна, межклеточная жидкость, спинномозговая жидкость и др.) имеют слабощелочную реакцию. При сдвигах их в кислую сторону, меняются биохимические процессы, организм закисляется.
3. Окислительно-восстановительный потенциал воды. Это способность воды вступать в биохимические реакции. Она определяется наличием свободных электронов в воде.
4. Жесткость воды - наличие в ней различных солей.
5. Температура воды определяет скорость протекания биохимических реакций.
6. Минерализация воды. Наличие в воде макро- и микроэлементов необходимо для жизнедеятельности организма человека. Жидкости организма представляют собой электролиты, восполняемые минералами, в том числе и за счет воды.
7. Экология воды - химическое загрязнение и биогенное загрязнение. Чистота воды - наличие в ней примесей, бактерий, солей тяжелых металлов, хлора и др.
8. Структура воды. Вода представляет собой жидкий кристалл. Диполи молекулы воды ориентируются в пространстве определенным образом, соединяясь в структурные конгломераты. Это позволяет жидкости составлять единую биоэнергоинформационную среду.
9. Информационная память воды. За счет структуры кристалла происходит запись информации, исходящей от биополя. Это одно из очень важных свойств воды, имеющее большое значение для всего живого.
10. Хадо - волновая энергетика воды.
Водородные связи
представляет собой взаимодействие между двумя электроотрицательными атомами двух одинаковых, или двух разных, молекул, посредством одного атома водорода. Водородная связь возможна за счет электростатического притяжения атома водорода, несущего положительный заряд δ+, к атому электроотрицательного элемента, несущего отрицательный заряд δ−. Чаще всего водородная связь слабее ковалентной, однако, значительно сильнее обычного физического притяжения молекул друг к другу, наблюдаемого в твердых и жидких средах. От межмолекулярных взаимодействий водородную связь отличает наличие свойств, обозначаемых как направленность и насыщаемость. От этого ее часто относят к одной из разновидностей ковалентной химической связи. Водородную связь можно описать, пользуясь методом молекулярных орбиталей, как трехцентровуюдвухэлектронную связь.
Молекула воды имеет следующее строение:

Две поделенные электронные пары участвуют в образовании двух полярных ковалентных связей, а оставшиеся две неподеленные пары электронов тоже играют важную роль в свойствах воды. Все заместители у атома кислорода, включая неподеленные пары, стремятся расположиться как можно дальше друг от друга. Это приводит к тому, что молекула приобретает форму искаженного тетраэдра с атомом кислорода в центре. В четырех вершинах этого "тетраэдра" находятся два атома водорода и две неподеленные пары электронов. Но если смотреть только по центрам атомов, то получается, что молекула воды имеет угловое строение, причем угол Н–О–Н составляет примерно 105 градусов. Для возникновения водородных связей важно, чтобы в молекулах вещества были атомы водорода, связанные с небольшими, но электроотрицательными атомами 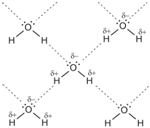 Рис. 7-1а. Водородные связи между молекулами воды (обозначены пунктиром)
Рис. 7-1а. Водородные связи между молекулами воды (обозначены пунктиром)
