Заочного этапа для учащихся 8 классов
…..
ЗАДАНИЯ и РЕШЕНИЯ
Очного (городского) этапа Санкт-Петербургской олимпиады школьников по химии
Для учащихся 8 классов
Задача № 1.
Бинарное соединение, содержащие углерод и водород, смешали в замкнутом сосуде со строго необходимым для реакции объемом кислорода при 1500С и смесь подожгли. После завершения реакции и приведения продуктов к первоначальной температуре давление в сосуде не изменилось. Установите формулу исходного соединения, если средняя молярная масса полученной смеси составила 33,6 г/моль.
Возможный вариант решения.
2СXHY + (2x+0,5y) O2 = 2х CO2 + y H2O
При температуре 1500С H2O – газ, по условию Р исх.= Р кон.,
следовательно n(СXHY) + n(O2) = n(CO2) + n(H2O); 2+2x+0,5y=2х+ y; y=4, следовательно соединение содержит Н4.
Мср.=[ n(CO2)* М(CO2)+ n(H2O)* М(H2O)] : [n(CO2)+ n(H2O) ]; [2х*44+4*18] : [2х+4]=33,6 ; х=3, следовательно соединение содержит С3 ; формула соединения С3Н4.
Задача 2.
Химик смешал 3 сложных вещества и получил соединение содержащие азот, водород, кислород и некоторый элемент Х в массовом соотношении 2,8 : 1,0 : 9,6 : 2,4 соответственно, причем количество вещества азота равно количеству вещества Х. Установите формулу соединения, назовите его и запишите уравнение химической реакции, которую осуществил Химик.
Возможный вариант решения.
n(N) : n(H) : n(X) : n(O) ; 2,8/14 : 1,0/1 : 9,6/16 : 2,4/х ; 0,2 : 1 : 0,6 : 0,2 ; 1:5:3:1 ; 2,4/х = 0,2 следовательно х=12 – углерод С.
Формула соединения – NH4HCO3, это гидрокарбонат аммония, возможный способ получения: NH3 + H2O + CO2 = NH4HCO3
Задача № 3.
Запишите уравнения химических реакций получения солей: а) из двух газообразных веществ, б) из двух твердых веществ, в) из твердого и газообразного веществ.
Возможный вариант решения.
а) NH3 + HCl = NH4Cl; б) 3CaO + P2O5 = Ca3(PO4)2 ; в) CaO + CO2 = CaCO3
Задача № 4.
Завершите уравнения химических реакций:
| 1. | Ca(HCO3)2 | + | → | H2O | + | + | |||
| 2. | HgCl | + | → | Hg | + | + | |||
| 3. | 2 KOH | + | → | K2CO3 | + | + | |||
| 4. | KOH | + | → | NH3 | + | + | |||
| 5. | FeS | + | → | FeCl2 | + | + | |||
| 6. | + | → | Fe(OH)2 | + | BaSO4 | + | |||
| 7. | CaCO3 | + | → | Ca(NO3)2 | + | + | |||
| 8. | Fe | + | → | Cu | + | + | |||
| 9. | 6 LiOH | + | → | 3 Li2SO4 | + | + | |||
| 10. | NH4HSO3 | + | → | NH4 NO3 | + | + |
Возможный вариант решения.
| 11. | Ca(HCO3)2 | + | Ca(OH)2 | → | H2O | + | 2CaCO3 | ||
| 12. | 2HgCl | + | Fe | → | 2Hg | + | FeCl2 | ||
| 13. | 2 KOH | + | CO2 | → | K2CO3 | + | H2O | ||
| 14. | KOH | + | NH4Cl | → | NH3 | + | H2O | + | НCl |
| 15. | FeS | + | 2НCl | → | FeCl2 | + | Н2S | ||
| 16. | FeSO4 | + | Ba(OH)2 | → | Fe(OH)2 | + | BaSO4 | ||
| 17. | CaCO3 | + | 2НNO3 | → | Ca(NO3)2 | + | H2O | + | CO2 |
| 18. | Fe | + | CuSO4 | → | Cu | + | FeSO4 | ||
| 19. | 6 LiOH | + | Al2(SO4)3 | → | 3 Li2SO4 | + | 2Al(OH)3 | ||
| 20. | NH4HSO3 | + | НNO3 | → | NH4 NO3 | + | H2O | + | SO2 |
Задача № 5.
Предложите способ разделения смеси железных опилок, оксида меди (II), оксида цинка и порошкообразного угля. Все эти вещества должны после разделения находится в том же химическом соединении в котором они присутствуют в смеси. Напишите уравнения используемых реакций.
Возможный вариант решения.
Из всех компонентов железо обладает магнетизмом и его можно отделить магнитом. Далее, на оставшуюся смесь действуем соляной кислотой, растворяются соли цинка и меди, и отфильтровываем уголь. Оставшийся раствор солей обрабатываем избытком щелочи, получая осадок гидроксида меди и раствор гидроксокомплекса цинка. Отделяем осадок от раствора. Раствор гидроксокомплекса цинка обрабатываем кислотой, добавляя ее по каплям для полного осаждения гидроксида цинка. Полученные гидроксиды нагревают на воздухе с образованием оксидов.
Уравнения протекаемых химический реакций.
ZnO + 2HCl → ZnCl2 + H2O
CuO + 2HCl → CuCl2 + H2O
ZnCl2 + 4NaOH → Na2Zn(OH)4 + 2NaCl
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Na2Zn(OH)4 + 2HCl → Zn(OH)2 + 2NaCl + 2H2O
Cu(OH)2 → CuO + H2O
Zn(OH)2 → ZnO + H2O
Задача № 6.
Газовую смесь (состав приведен в таблице) объемом 5 литров (н.у.) пропустили через 50 г горячего раствора гидроксида калия с массовой долей КОН 20%, так что хлороводород и хлор полностью поглотились. Какие вещества оказались в растворе и какова их масса?
| Состав газовой смеси (объемные доли, %) | НСl | Cl2 | N2 |
Возможный вариант решения.
V (НСl)=1,25 л, V (Cl2)=0,15 л; n(НСl)=0,556 моль, n(Cl2)=0,0067 моль.
1) КOH + НСl = КСl + H2O
2) 6КOH + 3Cl2 = КСlО3 + 5КСl + 3H2O
n(КСl)= n(КСl)1+ n(КСl)2= n(НСl)1+5/3 n(Cl2)2 = 0,0556 + 0,0112 = 0,0668 моль
n(КСlО3)= 1/3n(Cl2)2 = 0,0022 моль
m (КСl) ≈ 5 г m (КСlО3) ≈ 0,3 г
ЗАДАНИЯ и РЕШЕНИЯ
Отборочного (районного) этапа для учащихся 9 -11 классов
Класс
Задача 1
1 вариант
Какой объем кислорода необходим для сгорания 3 л смеси аммиака и водорода, плотность которой по воздуху равна 0,12? Объемы измерены при одинаковых условиях.
Решение:
Относительная молекулярная масса смеси: 29*0,12 = 3,48
Находим долю каждого газа в смеси: 17х + 2(1-х) = 3,48 . Из этого уравнения рассчитываем долю аммиака – 0,1 и долю водорода – 0,9 .
Следовательно, в смеси было 0,3 л аммиака и 2,7 л водорода
Уравнения горения газов:
0,3 л 0,225 л
4NH3 + 3O2 à 2N2 + 6H2O
4 л 3 л
2,7 л 1,35 л
H2 + 0,5O2 à H2O
По этим уравнениям находим общий объем кислорода: 0,225 + 1,35 = 1,575 (л).
2 вариант
Какой объем воздуха необходим для сгорания 10 м3 смеси пропана (С3Н8) и водорода, плотность которой по гелию равна 9,95? Объемы измерены при одинаковых условиях.
Решение:
Относительная молекулярная масса смеси: 4*9,95 = 39,8
Находим долю каждого газа в смеси: 44х + 2(1-х) = 39,8 . Из этого уравнения рассчитываем долю пропана – 0,9 и долю водорода – 0,1 .
Следовательно, в смеси было 9 м3 пропана и 1м3 водорода
Уравнения горения газов:
0,9м3 4,5м3
С3Н8 + 5O2 à 3CO2 + 4H2O
0,1м3 0,05м3
H2 + 0,5O2 à H2O
По этим уравнениям находим общий объем кислорода: 4,5 + 0,05 = 4,55 (м3).
Воздуха необходимо в 5 раз больше: 4,55*5 = 22,75 (м3).
Задача 2
1 вариант
В трех склянках без надписей находятся растворы следующих веществ: едкого натра, фторида калия и нашатыря. Как с помощью одного реактива определить эти растворы? Напишите уравнения соответствующих реакций в молекулярном и ионном виде, укажите признаки их протекания.
Растворы: NaOH (каустическая сода), KF, NH4Cl (нашатырь).
Реактив – раствор AgNO3. Уравнения реакций:
2NaOH + 2AgNO3 = 2NaNO3 + Ag2Oi + H2O (Ag2O -бурый осадок)
2Na+ + 2OH- + 2Ag+ + 2NO3- = 2Na+ + 2NO3- + Ag2Oi + H2O
2OH- + 2Ag+ = Ag2Oi + H2O
KF + AgNO3 = реакция не идет
NH4Cl + AgNO3 = Ag Cli + NH4 NO3 (Ag Cli - белый осадок)
NH4+ + Cl- + Ag+ + NO3- = Ag Cli + NH4+ + NO3-
Cl- + Ag+ = Ag Cli
2 вариант
В трех склянках без надписей находятся растворы следующих веществ: азотной кислоты, ляписа и аммонийной селитры. Как с помощью одного реактива определить эти растворы? Напишите уравнения соответствующих реакций в молекулярном и ионном виде и укажите их признаки.
Решение:
Растворы: HNO3, AgNO3 (ляпис) , NH4 NO3 (аммонийная селитра).
Реактив – раствор КОН. Уравнения реакций:
HNO3 + КОН = КNO3 + H2O (нет видимых изменений)
Н+ + NO3- + К+ + OH- = К+ + NO3- + H2O
Н+ + OH- = H2O
2AgNO3 + 2КОН = Ag2O↓ + H2O + 2КNO3
2Ag+ + 2NO3- + 2К+ + 2OH- = Ag2O↓ + H2O + 2К+ + 2NO3-
2Ag+ + 2OH- = Ag2O↓ + H2O
NH4 NO3 + КОН = КNO3 + NH3 + H2O
NH4+ + NO3- + К+ + OH- = К+ + NO3- + NH3↑ + H2O
NH4+ + OH- = NH3↑ + H2O
Задача 3
1 вариант
Термохимическое уравнение разложения нитрата меди имеет вид:
2Cu(NO3)2(тв) = 2CuO(тв) + 4NO2(тв) + O2(г) – 613,6 кДж
Вычислите теплоту образования нитрата меди, если известно, что теплоты образования оксида меди (II) и оксида азота (IV) равны 155,1 и –33,8 кДж/моль соответственно.
Решение:
2Cu(NO3)2(ТВ.) = 2CuO(ТВ.) + 4NO2(г.) + O2(г.) - 613,6 кДж или
Cu(NO3)2(ТВ.) = CuO(ТВ.) + 2NO2(г.) + 0,5O2(г.) - 306,8 кДж
По следствию из закона Гесса тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ. Причем, теплота образования простых веществ принята равной нулю.
На этом основании составляем выражение:
Q(реакции) = q(CuO) + 2q(NO2) - q(Cu(NO3)2). Отсюда получаем:
q(Cu(NO3)2) = q(CuO) + 2q(NO2) - Q(реакции)
Подставляем в это выражение известные теплоты образования и находим теплоту образования нитрата меди:
q(Cu(NO3)2) = 155,1 + (-33,8*2) – (-306,8) = 394,3 кДж
2 вариант
Термохимическое уравнение обжига сульфида цинка имеет вид:
2ZnS(тв.) + 3O2(г.) = 2ZnO(тв.) + 2SO2(г.) + 885,7 кДж
Вычислите теплоту образования оксида серы (IV), если известно, что теплоты образования оксида и сульфида цинка равны 347,8 и 201,5 кДж/моль соответственно.
Решение:
2ZnS(ТВ.) + 3O2(г.) = 2ZnO(ТВ.) + 2SO2(г.) + 885,7 кДж или
ZnS(ТВ.) + 1,5O2(г.) = ZnO(ТВ.) + SO2(г.) + 442,85 кДж
По следствию из закона Гесса тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ. Причем, теплота образования простых веществ принята равной нулю.
На этом основании составляем выражение:
Q(реакции) = q(ZnO) + q(SO2) - q(ZnS). Отсюда получаем:
q(SO2) = - q(ZnO) + q(ZnS) + Q(реакции)
Подставляем в это выражение известные теплоты образования и находим теплоту образования оксида серы (IV):
q(SO2) = - 347,8 + 201,5 + 442,85 = 296,55 кДж
Задача 4
1 вариант
В мерную колбу объемом 250 мл поместили 3,58 г кристаллогидрата Cr2(SO4)3·18H2O. Затем в колбу налили дистиллированной воды, добились растворения соли, довели водой до метки и перемешали. Сколько моль ионов SO42- содержится в одном литре такого раствора?
Cr2(SO4)3.18H2O
М = 716 г/моль
Число молей соли: 3,58 : 716 = 0,005 (моль)
0,005 моль 0,015 моль
Cr2(SO4)3 = 2Cr3+ + 3SO42-
1 моль 3 моль
Концентрация (SO42-) равна: 0,015 : 0,25 = 0,06 (моль/л)
2 вариант
Имеется раствор хлорида железа (III) с концентрацией 0,03 моль ионов Cl- в одном литре. Какая масса кристаллогидрата FeCl3.6H2O получится при медленном испарении 200 мл такого раствора?
Решение:
Число моль ионов Cl- в 200 мл в 5 раз меньше: 0,03 : 5 = 0,006 (моль)
FeCl3 = Fe3+ + 3Cl-
1 моль 3 моль
Число молей соли в три раза меньше (см.равнение диссоциации) : 0,006: 3 = 0,002 (моль)
М (FeCl3*6H2O) = 276,5 г/моль
Масса (FeCl3*6H2O) = 0,002*276,5 = 0,553 (г).
Задача 5
1 вариант
При обработке 17,40 гсмеси железа, алюминия и меди концентрированной азотной кислотой выделилось 4,48 л газа (н.у.), а при действии на такую же массу смеси соляной кислоты – 8,96 л газа (н.у.). Определите состав смеси металлов в массовых долях.
Решение:
С концентрированной азотной кислотой реагирует только медь:
6,4 г 4,48 л
Cu + 4HNO3 = Cu(NO3)2 + 2NO2h + 2H2O (1)
64 г 44,8 л
По этому уравнению (1) находим массу меди: 6,4 г .
Масса смеси железа и алюминия: 17,4 – 6,4 = 11 (г)
С соляной кислотой реагируют железо и алюминий:
Fe + 2HCl = FeCl2 + H2h (2)
56 г 22,4 л
2Al + 6HCl = Al Cl3 + 3H2h (3)
54 г 67,2 л
На основе уравнений 2 и 3 составляем алгебраическое уравнение:
(Х:56)*22,4 + (11 – Х): 27*1,5*22,4 = 8,96 , где Х – масса железа в смеси.
Решая это алгебраическое уравнение находим массу железа: 5,6 г .
Масса алюминия: 11 – 5,6 = 5,4 (г).
W (Cu) = 6,4 : 17,4 = 0,368 или 36,8%
W (Fe) = 5,6 : 17,4 = 0,322 или 32,2%
W (Al) = 5,4 : 17,4 = 0,310 или 31,0%
2 вариант
Определите состав смеси меди, железа и алюминия в массовых долях, если известно, что при действии на 19,5 г этой смеси раствором гидроксида натрия выделилось 10,08 л газа (н.у.), а при действии на такую же массу смеси соляной кислотой 13,44 л газа (н.у.)
Решение:
С гидроксидом натрия реагирует только алюминий
10,08 л
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2h 1)
54 г 67,2 л
С раствором соляной кислоты реагируют железо и медь:
Fe + 2HCl = FeCl2 + H2h (2)
56 г 22,4 л
2Al + 6HCl = Al Cl3 + 3H2h (3)
54 г 67,2 л
По уравнению (1) находим массу алюминия:
(54*10,08) : 67,2 = 8,1 (г) .
Алюминий с соляной кислотой реагирует с выделением водорода в такой же стехиометрии, как и с гидроксидом натрия (см. уравнения 1 и 3). Значит объем водорода, выделенного алюминием из соляной кислоты равен 8,96 л .
Объем водорода, который выделило железо из соляной кислоты, равен:
13,44 – 8,96 = 4,48 (л). По этому объему водорода из уравнения (2) находим массу железа: (56*4,48) : 22,4 = 11,2 (г).
Масса меди в смеси: 19,5 – 8,1 – 11,2 = 0,2 (г)
W (Al) = 8,1 : 19,5 = 0,415 или 41,5 %
W (Fe) = 11,2 : 19,5 = 0,575 или 57,5%
W (Cu) = 0,2 : 19,5 = 0,010 или 1,0%
Класс
Задача 1
1 вариант
Навеску цинка массой 3,0 г сожгли в 0,5 л (н.у.) газа, имеющего при н.у. плотность 3,17 г/л, после чего реакционную смесь охладили до комнатной температуры и полностью растворили в 40% водном растворе гидроксида натрия (плотность 1,43 г/мл). Какой минимальный объем раствора щелочи для этого потребовался? Какова будет массовая доля растворенного вещества в полученном растворе?
Решение:
Для начала определим, о каком газе идет речь в задаче. Поскольку его
плотность при н.у. составляет 3.17 г/л, молярная масса этого газа равна:
М = 3.17·22.4 = 71.008 г/моль. По-видимому, искомый газ – хлор, при взаимодействии которого с цинком протекает реакция:
Zn + Cl2 = ZnCl2
По условию задачи в реакцию вступило 3.0/65.4 = 0.046 моль цинка и 0.5/22.4 = 0.022 моль хлора. Следовательно, после окончания реакции смесь содержит 0.024 моль цинка и 0.022 моль хлорида цинка.
При обработке смеси раствором гидроксида натрия протекают реакции:
ZnCl2 + 4NaOH = 2NaCl + Na2[Zn(OH)4]
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Для растворения смеси требуется не менее (4·0.022 + 2·0.024) ·40 = 5.44 г гидроксида
натрия, что соответствует 13.6 г (или 9.51 мл) водного раствора этой щелочи.
При взаимодействии выделится 0.024 моль (0.048 г) водорода.
Масса раствора после окончания реакции составит: 13.6 + 3 + 0.5·3.17 – 0.048 =18.137 г
Масса растворенного вещества (тетрагидроксоцинката натрия и хлорида натрия) – 0.046·179.4 + 0.022·58.5 = 9.539 г
Массовая доля растворенного вещества: 9.539/18.137 = 52.6%
2 вариант
Навеску алюминия массой 2,0 г обработали при нагревании 1,0 л (н.у.) газообразного вещества, имеющего при 100 оС плотность 5,23 г/л, после чего реакционную смесь охладили до комнатной температуры и полностью растворили в 40% водном растворе гидроксида калия (плотность 1,40 г/мл). Какой минимальный объем раствора щелочи для этого потребовался? Какова будет массовая доля растворенного вещества в полученном растворе?
Решение:
Для начала определим, о каком газе идет речь в задаче. Поскольку его плотность при н.у. составляет 5.23 г/л, молярная масса этого газа равна:
М = 5.23·22.4·373,15/273,15 = 159.936 г/моль. По-видимому, искомый газ – пары брома, при взаимодействии которых с алюминием протекает реакция:
2Al + 3Br2 = 2AlBr3
По условию задачи в реакцию вступило 2.0/27 = 0.074 моль алюминия и 1.0/22.4 = 0.0446 моль брома. Следовательно, после окончания реакции смесь содержит 0.044 моль алюминия и 0.030 моль бромида алюминия.
При обработке смеси раствором гидроксида калия протекают реакции:
AlBr3 + 4KOH = 3KBr + К[Al(OH)4]
2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 3H2
Для растворения смеси требуется не менее (4·0.030 + 0.044) ·56 = 9.184 г гидроксида
калия, что соответствует 22.96 г (или 16.4 мл) водного раствора этой щелочи.
При взаимодействии выделится 0.066 моль (0.132 г) водорода.
Масса раствора после окончания реакции составит: 22.96 + 2 + 7.14 – 0.132 = 31.968 г
Масса растворенного вещества (тетрагидроксоалюмината калия и бромида калия) – 0.044·134 + 0.030·3·119 = 16.606 г
Массовая доля растворенного вещества: 16.606/31.968 = 51.9%
Задача 2
1 вариант
Пользуясь Периодическим Законом Д. И. Менделеева, дайте характеристику элемента № 114 по следующей схеме: электронное строение атома, характерные степени окисления, 2-3 характерные реакции простого вещества, его высшего оксида и соответствующего гидроксида.
Решение:
Электронный паспорт элемента № 114: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d107p2
Поскольку речь идет о металле, отрицательные степени окисления для данного элемента должны быть нехарактерны. Тогда можно ожидать проявления данным элементов четырех степеней окисления: 0, +2, +4.
Характерные реакции простого вещества:
Э + 2F2 = ЭF4
Э + О2 = ЭО2
Э + I2 = ЭI2
Высший оксид и соответствующий ему гидроксид будут, вероятно, проявлять амфотерные свойства:
ЭО2 + 4HCl = ЭCl4 + 2H2O
ЭО2 + 2NaOH = Na2ЭO3 + H2O (сплавление)
ЭО2·nH2O + 4HCl = ЭCl4 + (2+n)H2O
ЭО2·nH2O + 2NaOH = Na2[Э(OH)6] + (n-2)H2O
2 вариант
Пользуясь Периодическим Законом Д. И. Менделеева, дайте характеристику элемента № 116 по следующей схеме: электронное строение атома, характерные степени окисления, 2-3 характерные реакции простого вещества, его высшего оксида и соответствующего гидроксида.
Решение:
Электронный паспорт элемента № 116: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d107p4
Поскольку речь идет о металле, отрицательные степени окисления для данного элемента должны быть нехарактерны. Тогда можно ожидать проявления данным элементов трех степеней окисления: 0, +2, +4, +6.
Характерные реакции простого вещества:
Э + 3F2 = ЭF6
2Э + 3О2 = 2ЭО3
Э + 2Br2 = ЭBr4
Высший оксид и соответствующий ему гидроксид будут, вероятно, проявлять кислотные свойства, высший оксид должен проявлять и свойства окислителя:
ЭО3 + 2КОН = К2ЭО4 + H2O
ЭО3 + СО = ЭО2 + СО2
Н2ЭО4 + 2КОН = К2ЭО4 + 2Н2О
Н2ЭО4 + КОН = КНЭО4 + Н2О
Задача 3
1 вариант
В раствор, содержащий равное число молей хлоридов железа(III), ртути (II) и магния, опустили оловянную пластинку массой 20,00 г. После окончания реакции ее масса изменилась на 2,00 г. Определите массы всех солей в полученном растворе.
Решение:
При взаимодействии материала пластинки с солями в растворе будут протекать реакции:
Sn + 2FeСl3 = SnCl2 + 2FeCl2
Sn + HgCl2 = SnCl2 + Hg
Изменение массы пластинки будет обусловлено растворением олова и выделением на пластинке ртути.
Пусть в растворе содержалось х моль хлорида ртути. Тогда в ходе реакции на пластинке выделилось х моль ртути, а в раствор перешло 1.5х моль олова (х при взаимодействии с солью ртути и 0.5х при взаимодействии с хлоридом железа).
Изменение массы пластинки составляет: х·200.6 – 1.5х·118.7 = 2.00 г. Тогда х = 0.091 моль
По окончании реакции в растворе будут содержаться:
х моль хлорида железа(II) – 11.56 г
1,5х моль хлорида олова (II) – 25,89 г
х моль хлорида магния – 8,65 г
2 вариант
В раствор, содержащий равное число молей нитратов железа(III), серебра и цинка, опустили медную пластинку массой 10,00 г. После окончания реакции ее масса изменилась на 1,52 г. Определите массы всех солей в полученном растворе.
Решение:
При взаимодействии материала пластинки с солями в растворе будут протекать реакции:
Cu + 2Fe(NO3)3 = Cu(NO3)2 + 2Fe(NO3)2
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Изменение массы пластинки будет обусловлено растворением меди и выделением на пластинке серебра.
Пусть в растворе содержалось х моль нитрата серебра. Тогда в ходе реакции на пластинке выделилось х моль серебра, а в раствор перешло х моль меди (0.5х при взаимодействии с солью серебра и 0.5х при взаимодействии с нитратом железа).
Изменение массы пластинки составляет: х·108 – х·63.5 = 1.52 г. Тогда х = 0.034 моль
По окончании реакции в растворе будут содержаться:
х моль нитрата железа(II) – 6.12 г
х моль нитрата меди (II) – 6.375 г
х моль нитрата цинка – 6.44 г
Задача 4
1 вариант
Укажите, какие из приведенных ниже факторов влияют на скорость взаимодействия железа с водным раствором хлорида меди(II): 1) температура; 2) давление; 3) освещение; 4) концентрация хлорида меди в растворе; 5) степень измельчения железа; 6) концентрация хлорида железа в растворе. Приведите номера правильных ответов, расположив их в порядке убывания. Ответ поясните.
Решение:
Ответ: 5, 4, 1.
При повышении температуры увеличивается число столкновений взаимодействующих частиц, а сами частицы обладают большей энергией (выше вероятность протекания реакции при столкновении)
С повышением концентрации хлорида меди растет вероятность столкновений
С увеличением степени измельчения железа увеличивается площадь соприкосновения двух фаз, растет вероятность столкновений
2 вариант
Равновесие в системе H2 + Br2 (газ)  2HBr (газ) + Q не смещается под влиянием следующих факторов: 1) температура; 2) давление; 3) освещение; 4) присутствие катализатора; 5) присутствие ингибитора; 6) концентрация паров брома. Приведите номера правильных ответов, расположив их в порядке убывания. Ответ поясните.
2HBr (газ) + Q не смещается под влиянием следующих факторов: 1) температура; 2) давление; 3) освещение; 4) присутствие катализатора; 5) присутствие ингибитора; 6) концентрация паров брома. Приведите номера правильных ответов, расположив их в порядке убывания. Ответ поясните.
Решение:
Ответ: 5, 4, 3, 2.
Катализатор и ингибитор одинаково влияют на скорости прямой и обратной реакции, потому смещения равновесия не происходит.
В ходе указанной реакции не меняется число молей газа, поэтому изменение давления не вызывает смещения равновесия.
Освещение может инициировать протекание реакции (но тогда вещества не находились в состоянии равновесия) и изменить скорость протекания (для прямой и обратной реакции – одинаково).
Задача 5
1 вариант
При гидрировании пропина недостатком водорода над никелевым катализатором получена смесь двух газов с плотностью по воздуху 1,39. Напишите уравнения протекающих реакций. Каков состав полученной смеси в объемных процентах? Рассмотрите все возможные варианты, укажите наиболее вероятный.
Решение:
Средняя молярная масса смеси газов: 29*1,39=40,31 г/моль
Водород можно исключить, т.к. он изначально присутствовал в недостатке, а никелевый катализатор достаточно активный.
Варианты состава смеси:
1) Пропин+пропан
40х+44(1-х)=40,31 х=0,9225 (х – мольная доля пропина)
91,54% пропина, 8,46% пропана по массе или 92,25% и 7,75% по объему
2) Пропин+пропен
40х+42(1-х)=40.31 х=0,845
83,85% пропина, 16,15% пропена по массе или 84,5 и 15,5% по объему, соответственно
Очевидно, что при таком большом избытке пропина вероятность последующего гидрирования пропена пренебрежимо мала, т.е. ответ – вариант 2
2 вариант
При гидрировании этина недостатком водорода над палладиевым катализатором получена смесь двух газов с плотностью по воздуху 0,90. Напишите уравнения протекающих реакций. Каков состав полученной смеси в объемных процентах? Рассмотрите все возможные варианты, укажите наиболее вероятный.
Решение:
Средняя молярная масса смеси газов: 29*0,9=26,1 г/моль
Водород можно исключить, т.к. он изначально присутствовал в недостатке, а палладиевый катализатор достаточно активный.
Варианты состава смеси:
1) Ацетилен+этан
26х+30(1-х)=26,1 х=0,975 (х – мольная доля ацетилена)
97,13% ацетилена, 2,87% этана по массе
Или 97,5% и 2,5% по объему, соответственно
2) Ацетилен+этилен
26х+28(1-х)=26,1 х=0,95
94,64% ацетилена, 5,36% этилена по массе
Или 95,00% и 5,00% по объему, соответственно
Очевидно, что при таком большом избытке ацетилена вероятность последующего гидрирования этилена пренебрежимо мала, т.е. ответ – вариант 2.
Задача 6
1 вариант
Расшифруйте цепочку превращений:

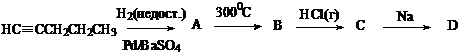
Составьте названия всех приведенных в задании органических соединений по номенклатуре IUPAC.
Решение:
А – пентен-1 (отравленный катализатор); В – пентен-2 (изомеризация в более устойчивый алкен); С – 3-хлорпентан (правило Марковникова). D – 3,4-диэтилгексан (реакция Вюрца).
2 вариант
Расшифруйте цепочку превращений
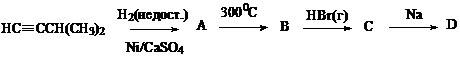
Составьте названия всех приведенных в задании органических соединений по номенклатуре IUPAC.
Решение:
А – 3-метилбутен-1 (отравленный катализатор); В – 2-метилбутен-2 (изомеризация в более устойчивый алкен); С -2-бром-2-метилбутан (правило Марковникова); D – 3,3,4,4-тетраметилгексан (реакция Вюрца).
Класс
Задача 1
1 вариант
Установите соответствие между названием соли и реакцией среды ее водного раствора:
| Соль: 1) валерат рубидия 2) нитрат галлия 3) бромид аммония 4) нитрит бария 5) сульфат хрома(III) | Реакция среды А) кислая В) нейтральная С) щелочная | |||||
| 1 | 2 | 3 | 4 | 5 | ||
Ответ подтвердите уравнениями реакций.
Решение:
| С | А | А | С | А |
C5H9O2Rb + H2O  C5H9O2H + RbOH
C5H9O2H + RbOH
C5H9O2- + H2O  C5H9O2H + OH–
C5H9O2H + OH–
Ga(NO3)3 + H2O  Ga(OH)(NO3)2 + HNO3
Ga(OH)(NO3)2 + HNO3
Ga3+ + H2O  Ga(OH)2+ + H+
Ga(OH)2+ + H+
NH4Br + H2O  NH4OH + HBr
NH4OH + HBr
NH4+ + H2O  NH4OH + H+
NH4OH + H+
Ba(NO2)2 + 2H2O  Ba(OH)2 + 2HNO2
Ba(OH)2 + 2HNO2
NO2– + H2O  HNO2 + OH–
HNO2 + OH–
Cr2(SO4)3 + 2H2O  2Cr(OH)(SO4) + H2SO4
2Cr(OH)(SO4) + H2SO4
Cr3+ + H2O  Cr(OH)+ + H+
Cr(OH)+ + H+
2 вариант
Установите соответствие между названием соли и реакцией среды ее водного раствора:
| Соль: 1) бензоат цезия 2) иодид аммония 3) нитрат свинца 4) трифторацетат железа(III) 5) фторид натрия | Реакция среды А) кислая В) нейтральная С) щелочная | |||||
| 1 | 2 | 3 | 4 | 5 | ||
Ответ подтвердите уравнениями реакций.
Решение:
| С | А | А | А | С |
C7H5O2Cs + H2O  C7H5O2H + CsOH
C7H5O2H + CsOH
C7H5O2- + H2O  C7H5O2H + OH–
C7H5O2H + OH–
NH4I+ H2O  NH4OH + HI
NH4OH + HI
NH4+ + H2O  NH4OH + H+
NH4OH + H+
Pb(NO3)2 + H2O  Pb(OH)(NO3) + HNO3
Pb(OH)(NO3) + HNO3
Pb2+ + H2O  Pb(OH)+ + H+
Pb(OH)+ + H+
Fe(CF3CO2)3 + H2O  Fe(OH)(CF3CO2)2 + CF3CO2H
Fe(OH)(CF3CO2)2 + CF3CO2H
Fe3+ + H2O  FeOH2+ + H+
FeOH2+ + H+
NaF + H2O  NaOH + HF
NaOH + HF
F– + H2O  HF + OH–
HF + OH–
Задача 2
1 вариант
Для определения количественного состава смеси тригидрата нитрата меди и гексагидрата нитрата железа(II) навеску смеси прокалили при 800 оС. Масса твердого остатка составила 30% от массы исходной смеси. Определите массовые доли компонентов в исходной смеси.
Решение:
2Cu(NO3)2·3H2O = 2CuO + 4NO2 + O2 + 6H2O
4Fe(NO3)2·6H2O = 2Fe2O3 + 8NO2 + O2 + 24H2O
Пусть был взят один моль смеси, в котором содержалось хмоль тригидрата нитрата меди. Тогда масса исходной смеси составляла:
m1 = х·241.5 + (1 – х)·288
По окончании реакции масса твердого остатка составит:
m2 = х·79.5 + (1 – х)/2·160
По условию задачи m2/m1 = 0.3
(х·79.5 + (1 – х)/2·160)/(х·241.5 + (1 – х)·288) = 0.3
x = 0.476
В 1 моль исходной смеси содержится 0.476 моль тригидрата нитрата меди (114.954 г) и 0.524 моль гексагидрата нитрата железа (150.912 г). Массовые доли компонентов составляют 43.2% и 56.8%, соответственно.
2 вариант
Для определения количественного состава смеси моногидрата нитрата ртути(II) и гексагидрата нитрата железа(II) навеску смеси прокалили при 800 оС. Масса твердого остатка составила 20% от массы исходной смеси. Определите массовые доли компонентов в исходной смеси.
Решение:
Hg(NO3)2·H2O = Hg + 2NO2 + O2 + H2O
4Fe(NO3)2·6H2O = 2Fe2O3 + 8NO2 + O2 + 24H2O
Пусть был взят один моль смеси, в котором содержалось хмоль моногидрата нитрата ртути Тогда масса исходной смеси составляла:
m1 = х·342.6 + (1 – х)·288
По окончании реакции масса твердого остатка составит:
m2 = (1 – х)/2·160
По условию задачи m2/m1 = 0.2
(1 – х)/2·160/(х·342.6 + (1 – х)·288) = 0.2
x = 0.246
В 1 моль исходной смеси содержится 0.246 моль моногидрата нитрата ртути (84.28 г) и 0.754 моль гексагидрата нитрата железа (217.15 г). Массовые доли компонентов составляют 27.96% и 72.04%, соответственно.
Задача 3
1 вариант
Как выделить в чистом виде компоненты из следующей смеси: фтороводород, азот, оксид азота(IV), углекислый газ, водород? В случае использования химических реакций приведите их уравнения.
Решение:
Один из вариантов решения:
Пропустим исходную смесь через 10% раствор серной кислоты. Хорошо растворимый в воде фтороводород перейдет в раствор, остальные газы останутся непоглощенными. Полученный раствор далее можно нейтрализовать гидроксидом натрия, выпарить, а твердую соль обработать концентрированной серной кислотой:
NaFтв. + H2SO4конц. = NaHSO4 + HF
Оставшиеся газы пропустим через баритовую воду. При этом будут поглощены углекислый газ и оксид азота:
Ва(ОН)2 + СО2 = ВаСО3 + H2O
2Ва(ОН)2 + 4NO2 = Ba(NO2)2 + Ba(NO3)2 + H2O
Выпавший осадок карбоната бария можно разложить нагреванием:
ВаСО3 = ВаO + СО2
Раствор нитрата и нитрита бария можно обработать концентрированной серной кислотой:
Ba(NO2)2 + Ba(NO3)2 + 2H2SO4конц. = 2ВaSO4 + 4NO2 + 2Н2О
Оставшуюся смесь азота и водорода можно разделить физическим методом – сжижением (первым в жидкость перейдет азот), диффузией через стекло (водород диффундирует) и т.п.
2 вариант
Как выделить в чистом виде компоненты из следующей смеси: угарный газ, водород, хлороводород, сернистый газ, метан? В случае использования химических реакций приведите их уравнения.
Решение:
Один из вариантов решения:
Пропустим исходную смесь через 10% раствор серной кисл
