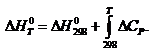Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
Система - это тело или группа тел, находящихся в взаимодействии, которые мысленно выделены из окружающей среды. Бывают гомогенными (однородные) и гетерогенными (неоднородные).
Изолированная система не имеет обмена веществом и энергией с окружающей средой.
Закрытая – не имеет только массообмена.
Открытая – имеет и энерго- и массообмен.
Фаза - совокупность всех гомогенных частей системы, одинаковых по составу и всем физ. и хим. свойствам, не зависящим от количества вещества. Фазы отделены друг от друга поверхностями раздела, на которых все свойства фазы резко скачком меняются.
Компоненты – сост-е части системы, химически индивидуальные вещества, составляющие данную систему и способные к самостоятельному существованию, будучи изолироваными от других частей системы.
Состояние системы определяется набором переменных величин - параметров. Различают параметры интенсивные и экстенсивные. Интенсивные - не зависят от массы или числа частиц в-ва. (P,T), а экстенсивные - зависят (V, E).
Функции состояния - это термодинамические функции, значения которых зависят только от состояния системы и не зависят от пути по которому система пришла в данное состояние. Изменение функции состояния 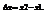
Наиболее важными функциями являются внутренняя энергия системы U и энтальпия (теплосодержание) 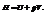
Внутр. энергия – общий запас энергии : энергия поступательного и вращательного движения, энергия колебаний, внутриядерная энергия, за исключением кинетической энергии системы в целом и потенциальной энергии положения системы.
Большое количество характеристик в химии зависят от условий, при которых они определяются. Наиболее общими и важными условиями являются температура и давление.
Стандартное давление - 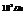
Стандартная температура – 298 К.
23. Стандартная энтальпия образования. Следствия из закона Гесса.Русский ученый Гесс (1840) дал формулировку основному закону термохимии: тепловой эффект реакции, протекающей при постоянном объеме или при постоянном давлении, не зависит от пути реакции (от ее промежуточных стадий), а определяется только природой и состоянием исходных веществ и продуктов реакции.Следствия из закона Гесса:1. тепловой эффект реакции равен разности между суммой теплот горения исходных веществ и суммой теплот горения продуктов реакции.Теплота горения – тепловой эффект реакции окисления данного соединения кислородом с образованием высших оксидов.Теплота образования – тепловой эффект реакции образования данного соединения из простых веществ.ю отвечающих наиболее устойчивому состоянию элементов при данных температуре и давлении.
2. тепловой эффект реакции равен разности между теплотами образования всех веществ, указанных в правой части уравнения, и теплотами образования веществ в левой части уравнения, взятых с коэффициентами перед формулами этих веществ в уравнении самой реакции.В настоящее время известны теплоты образования свыше 6000 веществ.Стандартные теплоты образования – величины теплот образования к температуре 298К и давлению 1атм
24. Зависимость теплового эффекта химической реакции от температуры (закон Кирхгофа).Температурный коэффициент теплового эффекта процесса равен изменению теплоемкости системы, происходящему в результате процесса (закон Кирхгоффа). 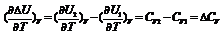
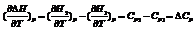
Чтобы подсчитать тепловой эффект процесса при некоторой температуре Т2, нужно знать тепловой эффект процесса при Т1, а также характер изменения теплоемкости системы в интервале температур Т1-Т2.
Обычно в роли Т1 выступает стандартная температура 298К.