Ков.(атомная) св.. Метод валентных связей. Возбужденные состояния атомов. Валентность.
К.с. возникает м/у элементами с одинаковым или близким знач-ми эн.сродства к электрону. Валентность атомов в соединениях с к.св.опр.по числу электронных пар(1пара–1ед.валентности).Для оценки отн.зарядности элемента в ков.соед-х (на самом деле никаких зарядов в этих соед-х нет) прибегают к приему: мысленно связь разорвать ,при разрыве связи в пределах периода электрон смещается от левее стоящего элемента к правее стоящего, а в пределах гл.подгр.от ниже стоящему к выше.2 метода объяснения механизма возн-нияков.св.: метод валентных связей (МВС) и метод молекулярных орбиталей (МО).В основе МВС лежит 3 положения: 1. Химическая связь образуется двумя электронами с противоположно направленными спинами. При этом имеет место взаимное перекрытие электронныхорбиталей. М/уатомами возникает зона повышенной электронной плотности, к которой притягиваются ядра с остальными электронами. 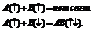
2. Связь имеет ориентацию в направлении, обеспечивающем макс.возможное перекрывание орбиталей.3.Чем больше взаимное перекрывание эл-ныхорбиталей, тем прочнее связь.Валентными являются неспаренные электроны. Их число можно изобр.c помощью эл-ной конфигурации атомов.Привозб-и атомов (за счет притока эн.извне) имеет место «распаривание» электронов и переход электрона на более удалённый подуровень в пределах одного уровня. Распаривание одной электронной пары может увеличить валентность на 2 единицы.
Образование химической связи. Энергия и длина связи.
При взаимодействии атомов между ними может возникнуть химическая связь, приводящая к образованию молекулы/иона/кристалла. Чем прочнее связь, тем больше требуется затратить энергии на ее разрыв.
При возникновении связи энергия выделяется, следовательно уменьшается потенциальная энергия системы электронов и ядер.
Потенциальная эн. образующейся молекулы меньше суммарной потенциальной эн.исходных свободных атомов.Для характеристики химической связи используются следующие термины:Длина связи - межъядерное расстояние в невозбуждённой молекуле (обычно 1-2 Ангстрема, 1А= 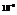 см).Эн.связи – энергия, выделяющаяся при образовании данного вида связи (150-1000 кДж/моль).
см).Эн.связи – энергия, выделяющаяся при образовании данного вида связи (150-1000 кДж/моль).
Периодич.з.Д.И.Менделеева и периодич.сист. эл-ов: ряды, периоды, группы, подгруппы, порядковый номер эл-та.
в 1869 сформулировав его:«Св-ва простых тел, а также формы и св-васоед.эл-ов находятся в периодич.зависимости от величины атомных весов эл-ов.» В 1869 было известно всего 63 элемента, в настоящее время – 109.
Периодич.сист.– по сути изобр.периодич.з..
В наст.вр.предложено несколько вариантов сист.,но мы рассмотрим более традиционную, предложенную Менделеевым.Она имеет 3 малых периода (1-3) и 4 больших (4-7).
Период – последовательность атомов с одинаковым числом эл-ныхслоев.Большие периоды содержать 2 ряда (четный и нечетный). Периоды нач-ся с активн.ме,по мере продвиж. ус-сянеметалл.св-ва, а завершаются галогеном и инертным газом.Эл-ты, которые осущ. переход от ме к неме,наз-сяпереходными. Эл-ты группы проявляют одинаковую макс.валентность по кислороду, равную номеру группы.Элементыгл.подгрупппроявляют опр.валентность по водороду. В главных подгруппахпо мере движ.внизметалл.св-ваусиливаются, побочных –ослабевают.
З.хим.экв-ов. Молярные экв-ные массы сложных в-в.
