Ответ: Соль образована катионом слабого двухкислотного основания и анионом сильной кислоты. Гидролиз идет по катиону. Раствор имеет кислую реакцию среды.

 1 ступень: Pb(NO3)2 + Н2О (PbOH)NO3 + HNO3
1 ступень: Pb(NO3)2 + Н2О (PbOH)NO3 + HNO3

 РЬ2+ + Н2О РЬОН- + Н+
РЬ2+ + Н2О РЬОН- + Н+

 2 ступень: (РЬОН)NО3 + Н2О Pb(OH)2 + НNО3
2 ступень: (РЬОН)NО3 + Н2О Pb(OH)2 + НNО3

 РbОН- + Н2О Pb(OH)2 + Н+
РbОН- + Н2О Pb(OH)2 + Н+
Пример 3.Написать уравнение гидролиза цианида аммония NH4OH. Какова реакция среды в водном растворе этой соли?
Ответ:Соль образована катионом слабого основания и анионом слабой кислоты, поэтому гидролиз идет как по катиону, так и по аниону:

 NH4CN + Н2О NH4OH + HCN
NH4CN + Н2О NH4OH + HCN

 NH4+ CN- + Н2О NH4OH + HCN.
NH4+ CN- + Н2О NH4OH + HCN.
Для оценки реакции среды необходимо сравнить константы диссоциации NH4OH и HCN (см. табл.1). Так как константа диссоциации гидроксида аммония больше, чем константа диссоциации синильной кислоты, то гидроксид аммония является более сильным электролитом. В растворе будут преобладать ионы ОН- , следовательно, реакция среды щелочная.
Пример 4.Учитывая только первую ступень гидролиза 0,5М раствора Na2S, рассчитайте константу гидролиза, степень гидролиза и рН среды.
Ответ:Гидролизу по первой ступени соответствует следующее ионно-молекулярное уравнение:

 S2- + Н2О НS- + OH-
S2- + Н2О НS- + OH-
Константа гидролиза Na2S пo первой ступени есть отношение ионного произведения воды к константе диссоциации слабой кислоты HS-.
Кг = Косн /К(HS-)
Константа диссоциации гидросульфид - иона представляет собой константу диссоциации H2S по второй ступени, ее значение можно взять из табл.1.
Кг = Косн /К2(H2S) = 10-14/4х10-14 = 0,25
Степень гидролиза можно рассчитать по формуле:
h= 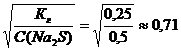
Для нахождения рН среды рассчитаем концентрацию водородных ионов:
[H+] = Kосн/С(Na2S) 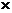 h=10-14/0,5
h=10-14/0,5 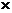 0.71 = 2.82
0.71 = 2.82 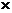 10-14 (моль/л).
10-14 (моль/л).
pH = -lg[H+] = -lg (2.82 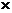 10-14) = 13,55
10-14) = 13,55 
ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОКОНТРОЛЯ
1. При хранении растворов солей гидролиз не желателен. Что нужно сделать, чтобы ослабить гидролиз сульфата кобальта (II)?
2. Какие из перечисленных ниже солей будут подвергаться гидролизу? Написать соответствующие молекулярные и ионно-молекулярные уравнения. Рассчитать для 0,2М растворов константу гидролиза, степень гидролиза и рН среды, учитывая только первую ступень гидролиза: K2SO4; NaClO4; Na2S; CuSO4; КNО3; РЬ(N03)2; (NН4)2СО3; КNO3.
3. При сливании растворов Al2(SO4)3 и Na2S выпадает белый осадок и ощущается неприятный запах. Объясните причину этого, приведя соответствующие уравнения реакций.
4. Почему раствор NаН2Р04, имеет слабокислую, а раствор Nа3Р04 щелочную реакцию? Ответ мотивировать соответствующими уравнениями реакций и расчетами. Воспользоваться данными табл.1 и 2.
5. Какие из приведенных ниже солей гидролизуются? Для гидролизующихся солей написать ионные и молекулярные уравнения гидролиза и указать реакцию раствора: NH4NO3, ВеСl2, К2S04, NаNО2, Nа2СО3, ВаС12, Al2(SO4)3, NазР04, FеS04, (NH4)2S, Са(СН3СОО)2.
6. Напишите ионные и молекулярные уравнения гидролиза солей и укажите качественно значение рН растворов: K2S03, СгС1з, СuS04, K2S, КзР04, Fе(NOз)з.
7. Что произойдет при нагревании и разбавлении растворов? Напишите уравнения реакций.
8. Вычислите константу гидролиза, степень гидролиза и рН растворов солей: а) 0,5М NH4NОз, б) 0,1М KNO2, в) 0,1М Nа2S, г) 0,3М FеС1з, д) 0,5М СНзСООNН4.
9. Рассчитайте Кг и рН 1М растворов NаН2Р04,Nа2НР04 и Nа3Р04. Какая из солей гидролизуется в наибольшей степени и почему? Сравнивая величины Кг и соответствующие Кк-ты, объясните, почему в растворе .NаН2P04 среда кислая, а в растворе Nа2НР04 - щелочная.
10. Напишите ионные и молекулярные уравнения реакций, происходящих при сливании растворов: а) А1(NО3)3 и (NH4)2S, б) Fe2(S04)3 и Nа2СО3, г) СгС1з и К2S03. Объясните смещение равновесия гидролиза и практически необратимое его протекание.
11. Вычислить степень гидролиза Na3PO4 по первой ступени в О,1м растворе. Какое значение рН этого раствора?
12. Вычислить константу, степень гидролиза и рН О,1 М раствора сульфита натрия.
13. Почему раствор NaHCO3 имеет слабощелочную, а раствор NaHSO3 слабокислую?
14. Вычислить степень гидролиза О,1 М раствора NaHS. Какое значение рН имеет этот раствор?
15. Какой рН имеют растворы NaHCO3 и NaHSO3? Объясните причину таких результатов.
16. рН О,1 М раствора натриевой соли некоторой органической кислоты равен 10. Вычислить константу диссоциации этой кислоты.
17. Вычислить константу, степень гидролиза и рН О,2 М раствора Na2CO3 и 0,01M NaHCO3.
18. Вычислить константу и степень гидролиза и рН 0,1 М раствора ортофосфата натрия.
19. Вычислить рН , константу и степень гидролиза 0,1 М раствора Na2CO3.
Таблица 2
Качественные и количественные характеристики растворов гидролизующих солей
| № | Тип соли | Реакция растворов | Продукты гидролиза | Кг | h | [H+] или [OH-] |
 1. 1. | Соль, образованная слабым основанием и сильной кислотой (гидролиз по катиону) | Кислая pН< 7 | Слабые основания или основные соли | Кн о Косн | 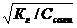 | [H+]=  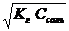  |
 2. 2. | Cоль, образованная слабой кислотой и сильным основанием (гидролиз по аниону) | Щелочная pН>7 | Слабые кислоты или кислые соли | Кн о Ккисл | 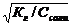 | [ОH-]= 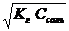 [H+]= [H+]=  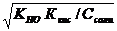 |
 3. 3. | Соль, образованная слабым основанием и слабой кислотой (гидролиз по аниону и по катиону). | Близкая к нейтраль ной pН = 7 | Слабые кислоты и слабые основания или кислые соли | Кн о КкКос | 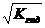 = = 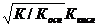 | [H+]=   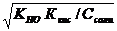 |
| 4. | Кислая соль, образованная слабой двухосновной кислотой и сильным основанием | pН>7 (Kг>Kкисл) рН <7 (Kг<Kкисл) | Слабая кислота | 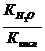 | 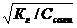 |  [H+]= [H+]= 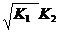 |

ЛИТЕРАТУРА
1. Ахметов Н.С. Общая и неорганическая химия. - М.: Высш. шк., 1981.
2. Глинка Н.Л.Общая химия. - Л.: Химия. 1983.
3. Любимова Н.Б. Вопросы и задачи по общей и неорганической химии. -М.: Высш. шк., 1990.
4. Глинка Н.А. Задачи и упражнения по общей химии. - Л.: Химия, 1985.
ЛАБОРАТОРНАЯ РАБОТА № 13.
БУФЕРНЫЕ РАСТВОРЫ.
Цель работы: приготовить буферные растворы и на их примере изучить свойства буферных растворов.
Оборудование и реактивы: штативы с пробирками, держатель для пробирок, индикаторы: фенолфталеин, метиловый оранжевый, лакмус, универсальная индикаторная бумага с цветной шкалой значения рН, рН-метр, 0,1 М растворы уксусной кислоты, ацетата натрия, гидроксида аммония, хлорида аммония, гидроксида натрия и соляной кислоты.
Буферными называют раствор, рН которого не изменяется при его разбавлении или добавлении небольших объемов сильной кислоты или сильного основания. Буферный раствор состоит из слабой кислоты и ее соли (СН3СООН-СН3ССОNa) или слабого основания и его соли (NH4OH - NH4Cl). Из слабых многоосновных кислот и их солей также можно приготовить буферные растворы, например Н3РО4 – NaH2PO4 и NaH2 РО4 – Na2HPO4 .
Значения рН буферного раствора, состоящего из кислоты и его соли, рассчитывают по уравнению
рН= рКНА- lg 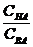 (1)
(1)
где: СНА и СВА- молярные концентрации кислоты и соли в буферном растворе, моль/л; КНА- константа диссоциации кислоты, моль/л.
Из уравнения 1 следует, что значения рН буферных растворов зависит только от отношения общих концентраций компонентов раствора и не зависит от разбавления (в определенных пределах). При изменении объема раствора концентрация каждого компонента изменяется в одинаковое число раз, а отношение концентраций не меняется.
При условии СНА= СВА отношение 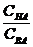 =1 и lg
=1 и lg 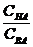 =о. То есть, рН= рКНА
=о. То есть, рН= рКНА
Для буферных растворов, состоящих из слабого основания ВОН и его соли ВА, значение рН рассчитывают по формуле
рН=14- рКВОН + lg 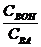 ( 2).
( 2).
Величину буферного действия характеризуют с помощью буферной емкости, равной числу молярных масс эквивалента сильной кислоты или сильного основания , которое можно добавить к 1 литру буферного раствора, чтобы рН изменился на единицу.
Буферная емкость зависит от природы и общих концентраций компонентов буферного раствора, а также от соотношения их концентраций. Чем больше концентрация компонентов буферного раствора и чем ближе к единице отношение 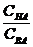 (в случае кислых буферов) и
(в случае кислых буферов) и 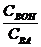 (в случае основных буферов), тем больше буферная емкость. Буферная емкость максимальна, когда вышеприведенные отношения равны единице.
(в случае основных буферов), тем больше буферная емкость. Буферная емкость максимальна, когда вышеприведенные отношения равны единице.
Если Б - буферная емкость, а и b- число молярных масс эквивалентов соответственно кислоты (НCl) и основания (NaOH), то
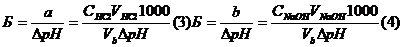
где 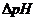 - изменение рН при добавлении данного количества кислоты или основания к объему (Vb) буферного раствора.
- изменение рН при добавлении данного количества кислоты или основания к объему (Vb) буферного раствора.
Опыт 1. Приготовление буферных растворов и определение их параметров.
1.1 Приготовление ацетатного и аммонийного буферных смесей.
Ацетатный буфер это водный раствор уксусной кислоты и ацетата натрия, а аммонийный буфер - гидроксида аммония и хлорида аммония. Для приготовления таких буферных смесей необходимо смешать равные объемы 0,1 М растворов уксусной кислоты с ацетатом натрия или гидроксида аммония с хлоридом аммония.
С помощью рН-метра определите значения рН этих смесей. Пользуясь справочными данными и с помощью уравнений 1 и 2 вычислите теоретические значения рН при условии 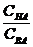 =1 и
=1 и 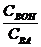 =1. Сопоставьте экспериментальные и теоретические значения рН.
=1. Сопоставьте экспериментальные и теоретические значения рН.
1.2. Влияние разбавления буферных смесей на значения рН.
Приготовьте по 5 образца растворов кислых и основных буферов путем последовательного 2-х кратного разбавления исходных буферных смесей. Измерьте значения рН всех растворов и сделаете вывод. Объясните наблюдаемые явления исходя их вышеизложенной теории о буферных смесях.
Опыт 2.Определение буферной емкости буферных смесей.
Работу выполнять парами. Каждая пара в стаканах для титрования готовит по 20 мл ацетатной и аммиачной буферных смесей. Каждый студент определяет емкость одного из этих растворов, а результаты измерений обобщают совместно.
Для определения буферной емкости растворов следует измерить начальные значения рН растворов (рН1). Затем добавьте из бюретки стандартный раствор NaOH (или НСl для аммиачного буфера) известной концентрации. Для оценки емкости достаточно, чтобы изменение рН составляло 0,1-0,3 единиц. Во избежания резких скачков рН стандартные растворы кислоты или щелочи добавить малыми порциями (по 1-2 мл.) до достижения стабильных значений рН на 0,1-0,3 единиц отличающиеся от начальных значений рН. Фиксировать объем израсходованного раствора кислоты или щелочи и с помощью уравнений 3 или 4 вычислите буферные емкости ацетатного и аммиачного буферных смесей.
ПРИМЕТЫ РЕШЕНИЯ ЗАДАЧ
Пример 1. Вычислить [Н+], [ОН-] и рН раствора, образовавшегося в результате смешивания 30 мл 0,1м раствора уксусной кислоты СН3СООН и 50 мл 0,3м раствора ацетата калия СН3СООК.
Ответ.Объем образовавшегося раствора образовавшегося в результате смешивания Vобщ= 30+50=80мл.
Концентрации уксусной кислоты и ацетата калия после смешивания
[СН3СООН] = 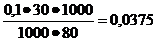 моль/л,
моль/л,
[СН3СООК] 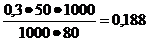 моль/л.
моль/л.
Так как ионы водорода образуются только за счет диссоциации уксусной кислоты, а ацетат анионы также и за счет диссоциации ацетата калия, то, принимая Х количество диссоцированной кислоты, получим:
[СН3СООН]ост = (0,0375- Х) моль/л; [Н+]= Х моль/л;
[СН3СОО-] = (0,188+ Х ) моль/л.
Из уравнения КHan = 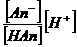 ; 1,74
; 1,74  10-5=
10-5= 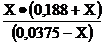
Так как Х<< 0,0375 то им можно пренебречь.
Тогда Х = [H+] = 3,5  10-6 моль/л; [OH-] = (10-14 /3,5
10-6 моль/л; [OH-] = (10-14 /3,5 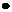 10-6 )моль/л;
10-6 )моль/л;
рН= -lg (3,5 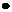 10-6) = 5,46.
10-6) = 5,46.
Такой же результат может получен, если пользоваться уравнением 1
рН = рКНА - lg 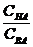 = - lg (1,74
= - lg (1,74 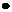 10-5) - lg
10-5) - lg 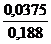 = 4,76 – (-0,7) = 5,46.
= 4,76 – (-0,7) = 5,46.
Пример 2. Определить рН раствора, получившегося в результате смешения
равных объемов растворов 0,12м СН3СООН и СН3СООК.
Ответ. После смешения Скис= Ссоль= 0,12/2=0,06 моль/л
Пользуясь уравнением рН = рКНА - lg 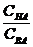 = -lg (1,74
= -lg (1,74  10-5 ) - lg
10-5 ) - lg 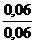 =
=
= 4,76 – lg1 = 4,76 - 0 = 4,76.
Пример 3. Сколько миллилитров 0,25м раствора ацетата калия СН3СООК следует прибавить к 50 мл 1,0 м раствора уксусной кислоты СН3СООН, чтобы получить буферную систему с рН=3,0?
Ответ: Подставим соответствующие значения в формулу:
рН = рКНА - lg 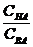 ; lg
; lg 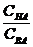 = рКНА – рН = 4,76-3=1,76;
= рКНА – рН = 4,76-3=1,76;
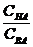 = 101,76 = 57,5; Это означает, что после смешения растворов в полученном растворе концентрация кислоты в 57,5 раза должна быть выше, чем концентрация соли. С растворе кислоты имеется 0,05
= 101,76 = 57,5; Это означает, что после смешения растворов в полученном растворе концентрация кислоты в 57,5 раза должна быть выше, чем концентрация соли. С растворе кислоты имеется 0,05  1,0=0,05 моль кислоты. Следовательно, количество вещества соли в этом растворе должно быть в 57,5 раза меньше, а именно 0,05:57,5=0,00087 моль ацетата калия.
1,0=0,05 моль кислоты. Следовательно, количество вещества соли в этом растворе должно быть в 57,5 раза меньше, а именно 0,05:57,5=0,00087 моль ацетата калия.
V=0,00087/ 0,25 = 0,00348л= 3,48 мл.
Пример 4. Буферная система, состоящая из дигидрофосфата калия КН2РО4 и гидрофосфата калия К2НРО4 приготовлена при мольном соотношении солей 16 : 1. Определить рН данного раствора.
Ответ: В данном случае кислотой является КН2РО4, то есть кислота Н2РО4- (К2= 6,2 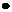 10-8 или рК = 7,2).
10-8 или рК = 7,2).
Используя уравнение рН = рКНА - lg 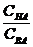 , получим: рН = 7,2 – lg16= 6,0
, получим: рН = 7,2 – lg16= 6,0
Пример 5. Вычислить рН буферного раствора, содержащего 0,2м NH4Cl и 0,2м NH4ОН.
В соответствии с уравнением 2, рН=14- рКВОН + lg 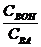 .
.
Так как рК (NH4ОН) = 4,755, то рН= 14 - 4,755 + lg 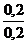 = 9,25 .
= 9,25 .
ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОКОНТРОЛЯ
1. Что такое буферные растворы? На чем основано их буферное действие?
2. Какое применение находят буферные растворы в быту, технике и науке?
3. Из каких веществ готовят буферные растворы? Можно ли приготовить буферный раствор исходя только из двух солей?
4. Приведите пример буферных растворов, состоящих из смеси солей.
5. Почему рН буферных растворов не меняется при их разбавлении?
6. Не прибегая к эксперименту, определите рН ацетатного и аммиачного буферных смесей, при условии, что в этих буферах концентрация соли равна концентрации кислоты (основания).
7. Какие параметры определяют буферную емкость?
8. Дайте определение понятию “Буферная емкость”.
9. Можно ли приготовить буферный раствор, смешивая сильную кислоту с её солью с сильным основанием или сильное основание с его солью с сильной кислотой?
10. Можно ли, исходя из одних и тех же компонентов, приготовить буферные смеси с различными значениями рН в широком диапазоне? Ответ мотивируйте с математическими выводами.
11. Вычислить рН и рОН буферной смеси, содержащей 0,1 мгидроксида аммония и 0,01м нитрата аммония.
12. Определить рН буферной смеси, состоящей из 0,01м раствора муравьиной кислоты и 0,02 м раствора формиата калия.
13. Сколько граммов формиата калия НСООК следует взять, чтобы при растворении в 25 мл 0,03м раствора муравьиной кислоты НСООН, получить смесь с рН=4,0?
14. 4,9г безводного ацетата калия растворили в 250мл 0,2н раствора уксусной кислоты. Определить рН раствора.
15. Сколько граммов хлорида аммония нужно растворить в 20 мл 0,5м раствора гидроксида аммония, чтобы получить концентрацию гидроксид ионов 5  10-4 моль/л.
10-4 моль/л.
16. Рассчитать рН буферного раствора, содержащего в 0,5л 30г уксусной кислоты и 41,0г ацетата натрия.
17. Рассчитать рН и рОН раствора, если к 1,0 литру воды прибавить 11,5г муравьиной кислоты и 10,5г формиата калия.
18. К 100 мл аммонийной буферной смеси добавили 400мл воды. Каков будет рОН раствора, если исходный имел рН равным 10,2?
19. Орпеделить рН буферного раствора, содержащего 1,1м NH4OH и 1,1м NH4Cl.
20. Определить рН буферного раствора, полученного при смешении 50 мл 0,1м раствора дигидрофосфата калия КН2РО4 и 25 мл 0,2м раствора гидрофосфата калия К2НРО4.
ЛАБОРАТОРНАЯ РАБОТА №14
