Внутренняя структура коллоидных частиц
Частицы коллоидных размеров (10-1000Å) могут иметь различную внутреннюю структуру. Можно выделить три типа внутренней структуры коллоидных частиц: суспензоиды, молекулярные и мицеллярные коллоиды.
Суспензоиды (лиофобные или необратимые коллоиды. Коллоидные частицы этого типа по своей внутренней структуре ничем не отличаются от структуры соответствующих им компактных веществ, таких, например, как металлы, их оксиды, гидроксиды, сульфиды или другие соли и соединения.
Лиофобными их называют потому, что особые свойства коллоидных растворов этого типа обусловлены очень слабым взаимодействием дисперсной фазы и дисперсионной среды.
Необратимыми их называют потому, что осадки, остающиеся после выпаривания таких коллоидных растворов, не образуют вновь золя (коллоидного раствора) при контакте с дисперсионной средой.
Строение коллоидных частиц суспензоидов. При рассмотрении строения коллоидных частиц следует отметить, что в разной литературе оно даётся неодинаково. С методической точки зрения наиболее удобен предложенный ниже способ, которого мы будем придерживаться при дальнейшем изложении. Для этого целесообразнее начать со следующего примера.
Как известно, при взаимодействии водных растворов нитрата серебра AgNO3 и иодида калия KI в количествах близких к стехиометрическому выпадает осадок AgI. Уравнение этой реакции можно записать в следующем виде:
mAgNO3 + mKI = mAgI↓ + mKNO3
где m – число молей соответствующее эквивалентному количеству компонентов (обычно при равенстве стехиометрических коэффициентов типа m их взаимно сокращают).
Если же один из этих реагентов взять в избытке (обозначим как m+n, где n – число молей реагента взятого в избытке), то выпадения осадка не происходит. Причина заключается в том, что в процессе зарождения и формирования кристаллов иодида серебра один из компонентов, необходимых для дальнейшего построения кристаллической решетки AgI, быстро заканчивается и рост кристалликов прекращается. Кристаллики AgI, образующиеся в этих условиях, не успевают достичь размеров, необходимых для осаждения, и удерживаются в растворе во взвешенном состоянии. Химическая реакция в этих случаях протекает точно также как и при эквивалентном соотношении компонентов, но с учётом избытка одного из реагентов её уравнение можно представить следующим образом:
При избытке KI
mAgNO3 + (m+n)KI = {[mAgI] nI – (n-x)K+}-х xK+ + mKNO3
При избытке AgNO3
(m+n)AgNO3 + mKI = {[mAgI] nAg+ (n-x)NO3¯}+х xNO3¯ + mKNO3
↓ ↓ ↓
где [ядро] ПОИ п р о т и в о и о н ы
(потенциал-
определяющие ионы)
{[ядро] адсорбционный } диффуз-
слой ный слой
{ коллоидная частица } диффуз-
ный слой
|------------------мицелла----------------|
При этом сформировавшиеся кристаллики AgI имеют размеры коллоидных частиц и образуют их нейтральное ядро. Одновременно ионы, оказавшиеся в растворе в избытке, в стремлении продолжить рост кристаллической решётки закрепляются (адсорбируются) на её поверхности в соответствующих позициях (узлах кристаллической решётки), придавая частице соответствующий электрический заряд. Их называют потенциалопределяющими ионами.
Роль потенциалопределяющих могут играть также и другие ионы, что отражает правило Фаянса: На поверхности ядра лиофобной мицеллы адсорбируются преимущественно те ионы, которые имеют с ядром общие химические элементы или обладают изоморфизмом с кристаллической решеткой ядра.
Поскольку все частицы формируются в одинаковых условиях, то и заряжаются одинаково. Это не даёт им возможности слипаться при столкновениях и, образуя более крупные агрегаты, выпадать в осадок. Заряженная таким образом поверхность частиц притягивает из раствора противоионы. Поскольку тех ионов, что необходимы для построения кристаллической решетки, в растворе не осталось, то притягиваются любые имеющиеся противоионы. При этом в силу их не идентичности кристаллической решётке полной нейтрализации заряда на поверхности не происходит. Только часть (n – x) из числа противоионов удерживается непосредственно около поверхности частицы и вместе с потенциалопределяющими ионами образуют неподвижный так называемый адсорбционный слой. Остальная же часть (х) противоионов, не удерживаемая поверхностью, остаётся в растворе и в результате теплового движения окружающей жидкости и диффузии стремится равномерно распределиться в нём, образуя подвижный диффузный слой.
Все вместе они образуют мицеллу. За пределами диффузного слоя заряд мицеллы нейтральный.
Схематично строение мицеллы можно представить с помощью следующего рисунка (см. рис.1).
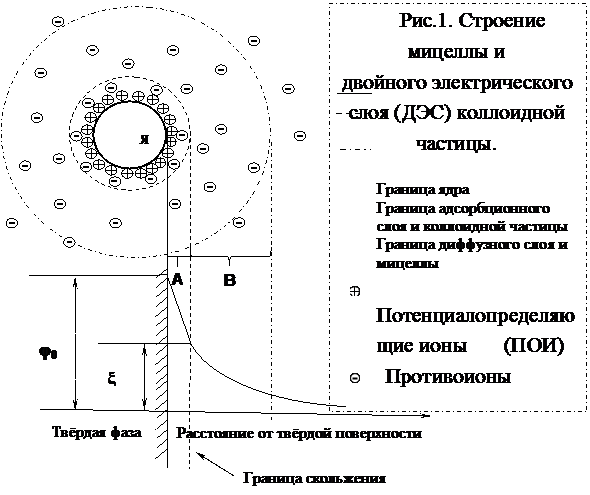 |
На границе раздела твёрдой и жидкой фаз за счёт избирательной сорбции ионов возникает двойной электрический слой (ДЭС), состоящий из тонкой адсорбционной (неподвижной) части и протяжённой диффузной (подвижной) части. Между фазами возникает разность электрических потенциалов. Максимальная разность потенциалов между всеми ионами называется электроповерхностным или термодинамическим потенциалом. При этом на границе подвижного и неподвижного слоёв мицеллы (граница скольжения) также имеется разность электрических потенциалов, называемая электрокинетическим или ξ(дзета)- потенциалом. Это означает, что в коллоидных растворах заряжены не только коллоидные частицы, но и дисперсионная среда. Всё это обуславливает проявление коллоидными растворами, присущей им специфики в виде электрических свойств и агрегативной устойчивости.
Наличие электрического заряда у частиц дисперсной фазы приводит к их значительной гидратации (полярные молекулы воды определённым образом ориентируются относительно заряженных частиц и вступают с ними во взаимодействие). Гидратная оболочка заметно снижает поверхностную энергию дисперсной фазы и тем самым уменьшает стремление частиц к укрупнению. Гидратная оболочка приводит также к разобщению (дезагрегации) коллоидных частиц в растворе, что повышает агрегативную устойчивость, а иногда даже обеспечивает сохранение коллоидной степени дисперсности. Поскольку поверхность ядра лиофобна, то сама она и сорбирующиеся на ней ионы (ПОИ) содержат незначительное количество воды. Сольватированы лишь противоионы, и главным образом, диффузного слоя. С учётом сказанного строение мицеллы правильнее показывать, например, следующим образом:
{[mAgI] nI – (n – x)K+ yH2O}-х xK+ zH2O
В редких случаях суспензоиды могут быть лиофильными. Например, при образовании золей кремниевой кислоты по схеме:
Na2SiO3 + HCl = H2SiO3↓ + NaCl
Строение мицеллы такого лиофильного золя можно представить следующей формулой:
{[mSiO2·jH2O] nSiO32-·2(n – x)H+·yH2O}2х- 2xH+·zH2O.
В отличие от лиофобных у лиофильных золей, не только диффузный слой, но и само ядро, и адсорбционный слой частицы содержат достаточно большое количество воды, а потому их поверхность хорошо смачивается водой.
Молекулярные коллоиды (обратимые и лиофильные). Коллоидные растворы этого типа образуют природные и синтетические высокомолекулярные соединения (ВМС) с молекулярной массой от десяти-пятнадцати тысяч до нескольких миллионов атомных единиц массы. Очень разбавленные растворы этих веществ гомогенны, т.е. являются истинными и подчиняются законам разбавленных растворов. Вместе с тем в зависимости от типа растворителя и химического строения отдельные макромолекулы способны сворачиваться в клубки–глобулы, которые по размерам сравнимы с коллоидными частицами. С повышением концентрации отдельные макромолекулы начинают взаимодействовать друг с другом с образованием надмолекулярных структур полимеров и свойства таких растворов всё больше отличаются от свойств растворов низкомолекулярных веществ.
Другой отличительной особенностью растворов молекулярных коллоидов является обратимость, то есть способность осадков, образовавшихся после удаления растворителя, вновь самопроизвольно переходить в раствор при добавлении новой порции растворителя.
Имеет свои характерные особенности и растворение полимеров. Оно проходит через стадию набухания. В зависимости от природы полимеров набухание может быть ограниченным и неограниченным. Ограниченно набухают так называемые сшитые полимеры, у которых отдельные макромолекулы имеют поперечные связи. Несшитые (линейные или разветвлённые) полимеры после предварительного набухания растворяются.
Мицеллярные или ассоциативные коллоиды. Коллоидные растворы данного типа (раньше их называли ещё полуколлоиды) образуют вещества с так называемой дифильной природой, содержащие в своём составе как неполярные, так и полярные (ионогенные) фрагменты. Такой природой обладают мыла, синтетические моющие вещества и другие поверхностно-активные вещества ПАВ. Обладая одновременно хорошей растворимостью в воде и многих органических растворителях, они при небольшой концентрации образуют истинные молекулярные растворы. Свойства таких растворов подчиняются законам истинных растворов.
С увеличением концентрации отдельные молекулы этих веществ начинают ассоциировать друг с другом с образованием сферических агрегатов или мицелл, размеры, которых соответствуют размерам коллоидных частиц. В зависимости от характера дисперсионной среды они могут ориентироваться вовне либо полярными, либо неполярными участками. В этих случаях возникает не молекулярный, а мицеллярный раствор или золь. При очень большой концентрации и небольшом количестве дисперсионной среды вместо сферических агрегатов образуются пластинчатые. Наиболее типичным примером образования таких агрегатов являются жидкие пены, характерные для очень тонких плёнок жидкости.
