Термохимия. термохимические уравнения. термохимические расчёты
Раздел химии или химической термодинамики, занимающийся расчётами тепловых эффектов, называется термохимией.
В этом случае в состав уравнения химических реакций вводят и их тепловой эффект, а также указывают фазовые состояния веществ (к – кристаллическое, т- твердое, ж- жидкость, г – газ, р- раствор). Например:
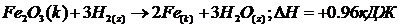
Поскольку условия получения различных веществ и их устойчивость в тех или иных условиях могут существенно различаться, вводят также и такие понятия как стандартные условия, стандартное состояние вещества и стандартная энтальпия образования вещества.
За стандартные условия принимают стандартное давление 0,1 Мпа, или 1 атм и стандартную температуру 25°С, или 298 К.
Стандартным состоянием вещества называется его состояние, наиболее устойчивое в стандартных условиях. Например, вода может находиться в трёх агрегатных состояниях: твёрдом (лёд), жидком и газообразном (пар). Из них при стандартных условиях наиболее устойчивым является жидкое, которое и считается стандартным. Для металлов, за исключением ртути, стандартным состоянием является твёрдое (кристаллическое), а для ртути - жидкое. Такие вещества, как водород Н2, углекислый газ С02, азот N2 и другие, в стандартном состоянии газообразны.
Энтальпии (теплоты) образования веществ в стандартном состоянии и стандартных условиях называются стандартными, и обозначаются символом 𝛥Н°298 обр или 𝛥Н°298 г. В последнее время - просто как 𝛥Н°298- Верхний индекс отмечает стандартное состояние вещества, нижний - стандартную температуру. Теплота образования вещества связана с его количеством и выражается в Дж/моль или кДж/моль.
Следует отметить, и это с очевидностью следует из принятого определения энтальпии образования вещества, что стандартные энтальпии образования простых веществ 𝛥Н°0бР298 (например, 02 (Г), Н2 (Г), С (графит) и др.) условно приняты равными нулю.
Если химический элемент образует несколько простых веществ, то стандартным считается наиболее устойчивое из них при стандартных условиях. Например, элемент кислород образует два простых вещества: О2 и Оз (озон). Известно, что наиболее устойчивым из них при стандартных условиях является О2, поэтому стандартная теплота его образования считается равной нулю. Теплота же образования озона составляет -142 кДж/моль, поскольку при его образовании из молекулярного кислорода О2 поглощается 142 кДж.
Теплоты (энтальпии) образования соединений, которые могут быть получены непосредственно из соответствующих простых веществ, определяют экспериментально. Их стандартные значения сведены в специальные термодинамические справочники. По справочным данным можно, не прибегая к эксперименту, рассчитывать тепловые эффекты различных реакций и проводить другие вычисления. Например, когда какое-то вещество невозможно экспериментально получить из простых веществ, то энтальпию его образования вычисляют, исходя из косвенных данных.
В основе термохимических расчётов реакций лежит закон Гесса:
Тепловой эффект реакции (ЛНР) не зависит от пути её протекания, а определяется только природой и физическим состоянием исходных веществ и конечных продуктов.
Этот закон был экспериментально установлен и имеет в настоящее время два практически важных следствия.
Согласно одному из них: Тепловой эффект реакции равен сумме теплот образования продуктов реакции 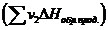 за вычетом суммы теплот образования исходных веществ
за вычетом суммы теплот образования исходных веществ 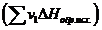 с учетом числа молей (v) всех участвующих в реакции веществ:
с учетом числа молей (v) всех участвующих в реакции веществ:
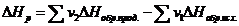 (1.10)
(1.10)
В общем случае тепловой эффект 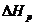 реакции типа:
реакции типа:
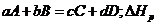
рассчитывается по уравнению
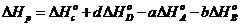
Согласно другому следствию, термохимические уравнения можно складывать, вычитать и умножать на численные множители.
В соответствии с законом сохранения энергии, система может самопроизвольно совершать "работу только за счёт собственной энергии, т.е. запас её внутренней энергии должен при этом уменьшаться или 𝛥U<0. В случае самопроизвольно протекающих химических реакций, это стремление к уменьшению запаса внутренней энергии может быть связано с выделением теплоты в виде экзотермического эффекта. Влияние этого фактора на направление самопроизвольного протекания различных процессов является одной из движущих сил химической реакции, а сам фактор называется энергетическим или энтальпийным. Но, наряду с ним, действует и другой фактор, иначе бы все химические реакции были экзотермическими. Этот фактор получил название структурного или энтропийного. Для понимания его природы необходимо рассмотреть ещё одну термодинамическую функцию состояния системы, получившую название «энтропия».
Мерой неупорядоченности или хаотичности системы в термодинамике служит энтропия (S). Обозначим энтропию исходного состояния данной системы как S1, энтропию конечного состояния как S2, а её изменение в процессе как 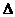 S = S2 - S1.Поскольку из опыта следует, что S2 > S1, то
S = S2 - S1.Поскольку из опыта следует, что S2 > S1, то 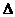 S >0. Стремление же различных термодинамических систем к увеличению энтропии называется структурным или энтропийным фактором и его преобладающим действием объясняется самопроизвольное протекание эндотермических процессов.
S >0. Стремление же различных термодинамических систем к увеличению энтропии называется структурным или энтропийным фактором и его преобладающим действием объясняется самопроизвольное протекание эндотермических процессов.
Энтропия зависит от всех видов движения частиц, составляющих систему, их количества, числа степеней свободы, агрегатного состояния и возрастает с повышением температуры. Поэтому в процессах, вызываемых увеличением движения частиц, т.е. при нагревании, испарении, плавлении, разрыве связей между атомами и т.п., энтропия возрастает. Наоборот, упрочнение связей, охлаждение, конденсация, кристаллизация, полимеризация, т.е. процессы, связанные с упорядочением системы, сопровождаются уменьшением энтропии.
Энтропия пропорциональна также массе вещества. Её обычно относят к одному моль вещества и выражают в Дж/моль*К.
Энтропия является функцией состояния системы.
Энтропия, отнесенная к стандартной температуре 25°С (298К) и стандартному давлению (1 атм), называется стандартной (S°298).
Одной из характерных особенностей энтропии в отличие от других термодинамических функций состояния является то, что можно определить её абсолютное значение. В термодинамических справочниках приводятся абсолютные значения стандартной энтропии веществ при 298 К на основании которых можно рассчитать стандартные энтропии тех или иных реакций.
Изменение энтропии системы в результате протекания химической реакции ( 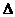 S) или энтропия реакции, как любой функции состояния системы, также не зависит от пути процесса, а определяется лишь энтропией начального и конечного состояний:
S) или энтропия реакции, как любой функции состояния системы, также не зависит от пути процесса, а определяется лишь энтропией начального и конечного состояний:
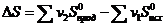 (1.26)
(1.26)
При суммировании следует учитывать число молей (V) всех участвующих веществ. В общем случае изменение энтропии 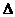 Sp в результате протекания химической реакции типа:
Sp в результате протекания химической реакции типа:
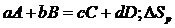
рассчитывается по уравнению
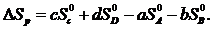 (1.27)
(1.27)
ЭНЕРГИЯ ГИББСА
Для решения одной из основных задач химической термодинамики - установления принципиальной возможности самопроизвольного протекания процессов - необходимо иметь объективный количественный критерий. Выше было показано, что действующими силами в различных процессах (в том числе и химических) выступают две конкурирующие тенденции или два противоположных фактора:
1. Энергетический, или энтальпийный, обусловленный стремлением системы перейти в состояние с наименьшей энергией, например, при р=const понизить энтальпию (𝛥H< 0);
2. Структурный, или энтропийный, обусловленный стремлением системы перейти в состояние с максимальной степенью разупорядоченности, т.е. повысить энтропию (𝛥S>0).
Если в ходе реакции степень беспорядка не изменяется (𝛥S=0), то направление процесса определяется изменением энтальпии и процесс проходит самопроизвольно в направлении уменьшения энтальпии (𝛥H< 0).
Если процесс происходит без изменения энтальпии (𝛥H=0), то фактором, определяющим направление реакции, является энтропия и процесс пойдет самопроизвольно в сторону её увеличения (𝛥S >0).
Если одновременно изменяются и энтальпия, и энтропия, то направление самопроизвольного протекания процесса определяется суммарной движущей силой реакции. Самопроизвольно реакция протекает в том направлении, в котором общая суммарная движущая сила системы будет уменьшаться.
С учетом одновременного действия этих двух противоположных факторов, такой движущей силой (функцией состояния) для реакций, протекающих при постоянной температуре и давлении, является энергия Гиббса (G), называемая также изобарно-изотермическим потенциалом, или свободной энергией.
В качестве критерия для определения направления самопроизвольного протекания химических процессов (при р=const используется изменение энергии Гиббса 𝛥G или
𝛥G=G2- G1 (1.27)
В зависимости от знака её изменения, возможны три случая.
1. 𝛥G < 0, реакция термодинамически возможна.
При постоянной температуре и давлении химические реакции протекают самопроизвольно только в направлении уменьшения энергии Гиббса в системе (𝛥G < 0).
Это положение связано с принципом минимума энергии, лежащим в основе второго закона термодинамики, одна из формулировок которого гласит:
«Теплота не может самостоятельно переходить от менее нагретого тела к более нагретому, самопроизвольно возможен лишь обратный процесс».
2. 𝛥G > 0, реакция термодинамически невозможна;
3. 𝛥G = 0, термодинамически возможны как прямая, так и обратная реакция.
Отсутствие изменения энергии Гиббса является термодинамическим условием установления химического равновесия в реакционной системе.
Энергия Гиббса связана с энтальпией, энтропией и температурой следующим образом:
G=H-T*S
Изменение энергии Гиббcа (𝛥G) при этом записывается в виде:
𝛥G = 𝛥Н – Т𝛥S (1.28)
Из уравнения 1.28 следует, что возможность самопроизвольного протекания химических реакций зависит от соотношения величины 𝛥Н и Т𝛥S. При этом возможны четыре основных случая:
1. Если 𝛥Н < 0, а 𝛥S > 0, то энергия Гиббcа всегда будет величиной отрицательной (𝛥G < 0). Такие реакции термодинамически возможны при любой температуре.
2. Если 𝛥Н > 0, а 𝛥S < 0, то всегда 𝛥G > 0. Такие реакции термодинамически невозможны при любых температурах.
3. Если 𝛥Н > 0 и 𝛥S > 0, то реакция возможна только при высоких температурах, когда | 𝛥Н | < | Т𝛥S |.
4. Если 𝛥Н <0 и 𝛥S <0, то реакция возможна при низких температурах, когда | 𝛥Н | > | Т𝛥S |.
Для проведения различных термодинамических расчетов, также как и в случае других термодинамических функций, вводят специальное понятие: стандартная энергия Гиббcа образования вещества (𝛥G°обр.298). Это - изменение энергии Гиббса в реакции образования одного моля соединения из соответствующих простых веществ, когда все участвующие вещества находятся в стандартном состоянии, а реакция проходит при стандартных условиях (измеряется обычно в кДж/моль). При этом:
Стандартная энергия Гиббса образования простых веществ условно принимается равной нулю.
В справочниках обычно приводятся значения стандартных энергий Гиббса образования вещества при 298 К. Зная величины 𝛥Н и 𝛥S, можно рассчитать значение 𝛥G при других температурах и, соответственно, предсказать возможность или невозможность самопроизвольного течения реакции.
Энергия Гиббcа является функцией состояния системы. Поэтому её изменение в ходе той или иной химической реакции зависит только от природы, физического или агрегатного состояния исходных веществ и продуктов реакции, их количества и не зависит от промежуточных стадий реакции или от того, каким путем данная реакционная система достигла конечного состояния, т.е.
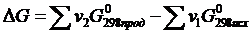 (1.29)
(1.29)
При суммировании обязательно учитывается число молей (v) всех участвующих веществ.
Пример 1. Вычислить 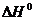 реакции, на основании стандартных теплот образования:
реакции, на основании стандартных теплот образования:
2Mg (к.) + CO2 (г.) = 2MgO (к.) + C (графит).
Решение. Используя стандартные энтальпии образования СО2 и MgO равны соответственно -393,5 и -601,8 кДж/моль (напомним, что стандартные энтальпии образования простых веществ равны нулю). Отсюда для стандартной энтальпии реакции находим:
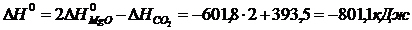
Пример 2. На основании стандартных теплот образования и абсолютных стандартных энтропий вещества вычислите 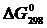 реакции, протекающей по уравнению
реакции, протекающей по уравнению
СО (г) + Н2О (ж) = СО2 (г) + Н2 (г)
Решение. 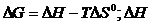 и
и 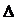 S – функции состояния, поэтому
S – функции состояния, поэтому
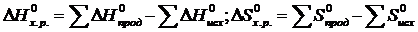
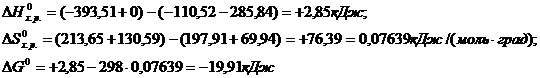
Пример 3. Восстановление Fe2O3 водородом протекает по уравнению




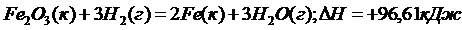
Возможна ли эта реакция при стандартных условиях, если изменение энтропии  S=0,1387 кДж/(моль/град)? При какой температуре начнется восстановление Fe2O3?
S=0,1387 кДж/(моль/град)? При какой температуре начнется восстановление Fe2O3?
Решение. 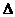 G0 реакции
G0 реакции 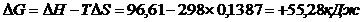 . Так как
. Так как 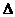 G>0, то реакция при стандартных условиях невозможна; наоборот при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой
G>0, то реакция при стандартных условиях невозможна; наоборот при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой 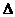 G=0:
G=0:
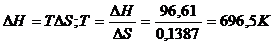
Следовательно, при температуре 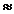 696,5К начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
696,5К начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
121. Вычислите энтальпию образования хлорида меди, если известно, что при образовании 8,10 г этой соли выделилось 13,39 кДж тепла. Ответ: 222,24 (кДж/моль).
122. Вычислите теплоту образования оксида железа, исходя из уравнения 8Al + 3Fe3O4 = 4Al2O3 + 9Fe, DH0 = -3326 кДж.Энтальпия образования Al2O3 = 1669 кДж/моль. Ответ: -1116,7 (кДж/моль).
123. Вычислите энтальпию перехода графита в алмаз, если известно, что энтальпия образования CO2 из графита равна - 393,5 кДж/моль, а из алмаза - 395,4 кДж/моль. Ответ: 2,1 (кДж/моль).
124. Вычислите изменение энтропии в реакции горения этана: C2H4(Г) + 3O2(Г) = 2CO2(Г) + 2H2O(Г). Ответ: -29,80 кДж/(моль×К).
125. Возможна или не возможна в стандартных условиях реакция. 4HCl + O2 = 2H2O + 2Cl2. Ответ обосновать.
126. При какой температуре наступит равновесие в системе BaO(кр.) + 0,5 O2(Г) D BaO2(кр.), если DH0х.р. = -81,51 кДж, а DS0х.р. = -0,11 кДж×К? Ответ: 458,90С.
127. При взаимодействии кристаллов хлорида фосфора (V) с парами воды образуется жидкий РОС13 и хлористый водород. Реакция сопровождается выделением 111,4 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите DH. Ответ: -111,4 (кДж/моль).
128. Вычислите энтальпию образования хлорида меди, если известно, что при образовании 8,10 г этой соли выделилось 13,39 кДж тепла. Ответ: 222,24 (кДж/моль).
129. Реакция горения этана выражается термохимическим уравнением: C2H6(г) + 3½O2 = 2 CO2(г) + 3H2O(ж); DHх.р = -1559,87 кДж.Вычислите теплоту образования этана, если известны теплоты образования СО2(г) и Н2О(ж). Ответ: -84,67 (кДж/моль).
130. Реакция горения этилового спирта выражается термохимическим уравнением: С2Н5ОН(ж) + 3О2(г) = 2СО2(г) + 3Н2О(ж); DН = ?Вычислите тепловой эффект реакции, если известно, что мольная (молярная) теплота парообразования С2Н5ОН(ж) равна +42,36 кДж и известны теплоты образования: С2Н5ОН(г); СО2(г); Н2О(ж). Ответ: -1366,87 (кДж/моль).
131. В каком состоянии энтропия 1 моль вещества больше: в кристаллическом или в парообразном при той же температуре? Ответ обосновать.
132. Прямая или обратная реакция будет протекать при стандартных условиях в системе: СН4(г) + СО2(г) 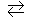 2СО(г) + 2Н2(г). Ответ обосновать.
2СО(г) + 2Н2(г). Ответ обосновать.
133. На основании стандартных теплот образования и абсолютных стандартных энтропий веществ вычислите DGо298 реакции, протекающей по уравнению:СО(г) + Н2О(ж) = СО2(г) + Н2(г). Ответ: -19,91 (кДж/моль).
134. Реакция восстановления Fe2O3 водородом протекает по уравнению: Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3Н2О(г); DН = +96,61 кДж.Возможна ли эта реакция при стандартных условиях, если изменение энтропии DS = 0,1387 кДж/(моль×К)? При какой температуре начнется восстановление Fe2O3? Ответ: 695,5 К.
135. Вычислите DНo, DSo и DGoT реакции, протекающей по уравнению: Fe2O3(к) + 3С = 2Fe + 3СО. Возможна ли реакция восстановления Fe2O3 углеродом при температурах 500 и 1000 К? Ответ: DНo=490,54 (кДж/моль), DSo= 541,1 кДж/(мольК), DGo500 = 219,99 (кДж/моль), DGo1000 = - 50,56 (кДж/моль).
136. Пользуясь справочными данными, а) рассчитать DH°298реакции: CH4(г) + CO2(г) = 2CO(г) + 2 H2(г), если прореагировало 10 л метана, б) Определить направление протекания данной реакции при Т = 798 К (принять Dср= const). Ответ: а) 101,43 (кДж/моль), б) -466,2 (кДж/моль).
137. Определите количество теплоты, выделяющейся при гашении 100 кг извести водой при 25°С, если известны стандартные теплоты образования веществ, участвующих в химической реакции: ∆Н°f CaO (к) = -635,1 кДж/моль; ∆Н°f Н2О (ж) = -285,84 кДж/моль; ∆Н°f Са(ОН)2 = -986,2 кДж/моль. Ответ: 116536 (кДж/моль)
138. Вычислите изменение энергии Гиббса в химической реакции по значениям теплот образования и энтропий реагирующих веществ и продуктов реакции. Возможна ли данная реакция? NH3 (г) + НСl (г) = NH4Cl (к). Ответ: -92.08 (кДж/моль)
139. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция Н2(Г) + СО2(Г) = СО(Г) + Н2О(Ж), Н0х.р. = -2,85 кДж. Ответ обосновать.
140. Вычислить ∆G для реакции CaCO3(K) = CaO(K) + CO2(Г) при 250С. Ответ: 129,1 (кДж/моль)
141. Какие из перечисленных оксидов могут быть восстановлены алюминием при 298 К: CaO, FeO, CuO? Ответ обосновать.
142. Какие из перечисленных оксидов могут быть восстановлены алюминием при 298 К: PbO, Fe2O3, Cr2O3? Ответ обосновать.
143. Указать знаки ∆Н и ∆S для процессов: а) испарение воды при 1000С при парциальном давлении паров воды 760 мм. Т. Ст., б) кристаллизация воды. Ответ обосновать.
144. Можно ли использовать при стандартных условиях нижеприведенную реакцию для получения аммиака: NH4Cl(K) + NaOH(K) = NaCl + H2O + NH3. Ответ обосновать.
145. Вычислить ∆G для реакции CaCO3(K) = CaO(K) + CO2(Г) при 15000С. Ответ: -122,01 (кДж/моль)
146. При сгорании 16 г магния выделилось 400,8 кДж. Определить энтальпию образования MgO(к.). Ответ: – 601,2 (кДж/моль)
147. Определите энтальпию реакции B2O3(к.) + 3 Mg(к.) = 2 B(к.) + 3 MgO(к.), DНреак = х кДж, если энтальпии образования B2O3(к.) и MgO(к.) равны соответственно –1272,8 и –601,2 кДж/моль. Ответ: – 530,8 кДж/моль
148. Определить стандартную энтальпию сгорания метана, если стандартные энтальпии образования CH4(г.), CO2(г.) и H2O(ж.) равны соответственно –74,8; –393,5 и –285,8 кДж/моль. Ответ: – 890,3 кДж/моль
149. Пользуясь данными справочника, определить, может ли при стандартной температуре самопроизвольно протекать реакция Fe2O3(к.) + H2(г.) = 2 FeO(к.) + H2O(г.)? Ответ обосновать.
150. Определите, возможно липри95oС самопроизвольноепротекание процесса Na2O(т) + H2O(ж) → 2NaOH(т). Ответ обоснуйте,рассчитав величину изменения энергии Гиббса приданной температуре. Ответ: ΔGo = –147,3 кДж.
КОНТРОЛЬНАЯ РАБОТА № 2
