Силы межмолекулярного действия, их природа и свойства.
Силы межмолекулярного действия, их природа и свойства.
Коллоидная химия
Силы межмолекулярного взаимодействия.
Когда вещество находится в газообразном состоянии, тогда образующие его частицы – молекулы или атомы – хаотически движутся и при этом преобладающую часть времени находятся на больших расстояниях (в сравнении с их собственными размерами) расстояниях друг от друга. Вследствии этого силы взаимодействия между ними пренебрежимо малы.
Иначе обстоит дело, когда вещество находится в конденсированном состоянии– в жидком или твёрдом. Здесь расстояния между частицами вещества малы и силы взаимодействия между ними велики. Эти силы удерживают частицы жидкости или твёрдого тела друг около друга. Поэтому вещества в конденсированном состоянии имеют, в отличии от газов, постоянный при данной температуре объём.
Все силы, удерживающие частицы жидкости или твёрдого тела друг около друга, имеют электрическую природу. Но в зависимости от того, что представляют собой частицы – являются ли они атомами металического или неметалического элемента, ионами или молекулами – эти силы существенно различны.
Неметалы с атомным строением
Если вещество состоит из атомов, но не является металлом, то его атомы обычно связаны друг с другом ковалентной связью.
Металлы
Если вещество – металл, то часть электронов его атомов становится общими для всех атомов. Эти электроны свободно движутся между атомами, связывая их друг с другом.
Вещества с ионным строением
Если вещество имеет ионное строение, то образующие его ионы удерживаются друг около друга силами электростатического притяжения.
Вещества с молекулярным строением
В веществах с молекулярным строением имеет место межмолекулярное взаимодействие.
Силы межмолекулярного взаимодействия, называемые также силами Ван-дер-Ваальса, слабее ковалентных сил, но проявляются на больших расстояниях. В основе их лежит электростатическое взаимодействие диполей, но в различных веществах механизм возникновения диполей различен.
Ориентационное взаимодействие.
Если вещество состоит из полярных молекул, например, Н2О, НCl, то в конденсированном состоянии молекулы ориентируются друг по отношению к другу своими разноимённо заряженными концами, вследствии чего наблюдается их взаимное притяжение.
Такой вид межмолекулярного взаимодействия называется ориентационным взаимодействием. Тепловое движение молекул препятствует их взаимной ориентации, поэтому с ростом температуры ориентационный эффект ослабевает.
Индукционное взаимодействие.
В случае веществ, состоящих из неполярных, но способных к поляризации молекул, например СО2, наблюдается возникновение наведённых или индуцированных диполей.
Причина их появления обычно состоит в том, что каждый атом создаёт вблизи себя электрическое поле, оказывающее поляризующее действие на ближайший атом соседней молекулы. Молекула поляризуется и образовавшийся индуцированный диполь в свою очередь поляризует соседние молекулы.
В результате происходит взаимное притяжение молекул друг к другу. Это индукционное взаимодействие наблюдается также и у веществ с полярными молекулами, но при этом оно обычно значительно слабее ориентационного.
Природа межмолекулярного взаимодействия
Межмолекулярное взаимодействие имеет электрическую природу и складывается из сил притяжения(ориентационных, индукционных и дисперсионных) и сил отталкивания.
Ориентационные силы
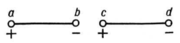
Два электрических диполяab и cd при указанномвзаимном расположениипритягиваются, т. к. разноимённые заряды вточках b и свзаимодействуют сильнее, чем одноимённые заряды вточках а и с (а также в b иd).
Ориентационные силы действуют между полярными молекулами, то есть обладающими дипольнымиэлектрическими моментами. Сила притяжения между двумя полярными молекулами максимальна в томслучае, когда их дипольные моменты располагаются вдоль одной линии (см. рисунок). Эта сила возникаетблагодаря тому, что расстояния между разноимёнными зарядами немного меньше, чем между одноимёнными. В результате притяжение диполей превосходит их отталкивание. Взаимодействие диполей зависит от ихвзаимной ориентации, и поэтому силы дипольного взаимодействия называются ориентационными. Хаотическое тепловое движение непрерывно меняет ориентацию полярных молекул, но, как показываетрасчёт, среднее по всевозможным ориентациям значение силы имеет определённую величину, не равнуюнулю. Потенциальная энергия ориентационного межмолекулярного взаимодействия:
Uop(r)~ 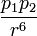 где p1 и p2 — дипольные моменты взаимодействующих молекул.
где p1 и p2 — дипольные моменты взаимодействующих молекул.
Соответственно сила взаимодействия: Fop~r − 7.
Сила Fор убывает с расстоянием значительно быстрей, чем кулоновская сила взаимодействия заряженныхтел (Fкул ~ r-2).
Индукционные силы
Индукционные (или поляризационные) силы действуют между полярной и неполярной молекулами. Полярнаямолекула создаёт электрическое поле, которое поляризует молекулу с электрическими зарядами, равномернораспределёнными по объёму. Положительные заряды смещаются по направлению электрического поля, аотрицательные — против. В результате у неполярной молекулы индуцируется дипольный момент.
Энергия межмолекулярного взаимодействия в этом случае пропорциональна дипольному моменту p1полярной молекулы и поляризуемости a2, характеризующей способность другой молекулы поляризоваться:
Uинд(r) ~ p1 a2 / r6.
Эта энергия называется индукционной, так как она появляется благодаря поляризации молекул, вызваннойэлектростатической индукцией. Индукционные силы (Fинд ~ r -7) действуют также и между полярнымимолекулами.
Дисперсионные силы
Между неполярными молекулами действует дисперсионное межмолекулярное взаимодействие. Природа этоговзаимодействия была выяснена полностью только после создания квантовой механики. В атомах и молекулахэлектроны сложным образом движутся вокруг ядер. В среднем по времени дипольные моменты неполярныхмолекул оказываются равными нулю. Но в каждый момент электроны занимают какое-то положение. Поэтомумгновенное значение дипольного момента (например, у атома водорода) отлично от нуля. Мгновенный дипольсоздаёт электрическое поле, поляризующее соседние молекулы. В результате возникает взаимодействиемгновенных диполей. Энергия взаимодействия между неполярными молекулами есть средний результатвзаимодействия всевозможных мгновенных диполей с дипольными моментами, которые они наводят всоседних молекулах благодаря индукции. Потенциальная энергия дисперсионного межмолекулярноговзаимодействия:
Uдисп(r) ~ a1a2 / r6 а Fдисп ~ r-7(здесь a1 и a2 — поляризуемости взаимодействующих молекул).
Межмолекулярное взаимодействие данного типа называется дисперсионным потому, что дисперсия света ввеществе определяется теми же свойствами молекул, что и это взаимодействие. Дисперсионные силыдействуют между всеми атомами и молекулами, так как механизм их появления не зависит от того, есть ли умолекул (атомов) постоянные дипольные моменты или нет. Обычно эти силы превосходят по величине какориентационные, так и индукционные. Только при взаимодействии молекул с большими дипольнымимоментами, например молекул воды, Fор > Pдисп (в 3 раза для молекул воды). При взаимодействии же такихполярных молекул, как CO, HI, HBr и других, дисперсионные силы в десятки и сотни раз превосходят всеостальные.
Очень существенно, что все три типа межмолекулярного взаимодействия одинаковым образом убывают срасстоянием:
U = Uop + Uинд + Uдисп ~ r-6
Силы отталкивания
Силы отталкивания действуют между молекулами на очень малых расстояниях, когда приходят всоприкосновение заполненные электронные оболочки атомов, входящих в состав молекул. Существующий вквантовой механике принцип Паули запрещает проникновение заполненных электронных оболочек друг вдруга. Возникающие при этом силы отталкивания зависят в большей степени, чем силы притяжения, отиндивидуальности молекул. К хорошему согласию с данными экспериментов приводит допущение, чтопотенциальная энергия сил отталкивания Uот возрастает с уменьшением расстояния по закону:
Uот(r) ~ r-12, a Fот ~ r-13.
Уравнение Ван-Дер-Ваальса
Ван дер Ваальс предположил, что на малых расстояниях (r) между молекулами действуют силы отталкивания, которые с увеличением расстояния сменяются силами притяжения. На основе этих представлений, даже нерассматривая количественной зависимости межмолекулярного взаимодействия от расстояния, он получил такназываемое Ван-дер-Ваальсово уравнение состояния реального газа.
Межмолекулярное взаимодействие
взаимодействие между электрически нейтральными молекулами или атомами; определяет существование жидкостей и молекулярных кристаллов, отличие реальных газов от идеальных и проявляется в разнообразных физических явлениях. М. в. зависит от расстояния r между молекулами и, как правило, описывается потенциальной энергией взаимодействия U(r) (потенциалом М. в.), так как именно средняя потенциальная энергия взаимодействия определяет состояние и многие свойства вещества.
Впервые М. в. принял во внимание Я. Д. ван дер Ваальс (1873) для объяснения свойств реальных газов и жидкостей. Ван дер Ваальс предположил, что на малых расстояниях r между молекулами действуют силы отталкивания, которые с увеличением расстояния сменяются силами притяжения. На основе этих представлений, даже не рассматривая количественной зависимости М. в. от расстояния, он получил так называемое Ван-дер-Ваальса уравнение состояния реального газа.
М. в. имеет электрическую природу и складывается из сил притяжения (ориентационных, индукционных и дисперсионных) и сил отталкивания.
Ориентационные силы действуют между полярными молекулами, то есть обладающими дипольными электрическими моментами (см. Диполь электрический). Сила притяжения между двумя полярными молекулами максимальна в том случае, когда их дипольные моменты располагаются вдоль одной линии (рис. 1). Эта сила возникает благодаря тому, что расстояния между разноимёнными зарядами немного меньше, чем между одноимёнными. В результате притяжение диполей превосходит их отталкивание. Взаимодействие диполей зависит от их взаимной ориентации, и поэтому силы дипольного взаимодействия называются ориентационными. Хаотическое тепловое движение непрерывно меняет ориентацию полярных молекул, но, как показывает расчёт, среднее по всевозможным ориентациям значение силы имеет определённую величину, не равную нулю. Потенциальная энергия ориентационного М. в. Uор(r) Межмолекулярное взаимодействие p1 p2 / r 6; где p1 и p2 — дипольные моменты взаимодействующих молекул. Соответственно сила взаимодействия Fор Межмолекулярное взаимодействие r -7. Сила Fор убывает с расстоянием значительно быстрей, чем кулоновская сила взаимодействия заряженных тел (Fкул Межмолекулярное взаимодействие r -2).
Индукционные (или поляризационные) силы действуют между полярной и неполярной молекулами. Полярная молекула создаёт электрическое поле, которое поляризует молекулу с электрическими зарядами, равномерно распределёнными по объёму. Положительные заряды смещаются по направлению электрического поля, а отрицательные — против. В результате у неполярной молекулы индуцируется дипольный момент.
Энергия М. в. в этом случае пропорциональна дипольному моменту p1 полярной молекулы и поляризуемости (См. Поляризуемость) α2, характеризующей способность другой молекулы поляризоваться: Uинд(r)Межмолекулярное взаимодействие p1 α2 / r 6. Эта энергия называется индукционной, так как она появляется благодаря поляризации молекул, вызванной электростатической индукцией. Индукционные силы (FиндМежмолекулярное взаимодействие r -7) действуют также и между полярными молекулами.
Между неполярными молекулами действует дисперсионное М. в. Природа этого взаимодействия была выяснена полностью только после создания квантовой механики (См. Квантовая механика). В атомах и молекулах электроны сложным образом движутся вокруг ядер. В среднем по времени дипольные моменты неполярных молекул оказываются равными нулю. Но в каждый момент электроны занимают какое-то положение. Поэтому мгновенное значение дипольного момента (например, у атома водорода) отлично от нуля. Мгновенный диполь создаёт электрическое поле, поляризующее соседние молекулы. В результате возникает взаимодействие мгновенных диполей. Энергия взаимодействия между неполярными молекулами есть средний результат взаимодействия всевозможных мгновенных диполей с дипольными моментами, которые они наводят в соседних молекулах благодаря индукции. Потенциальная энергия дисперсионного М. в. Uдисп(r) Межмолекулярное взаимодействие α1α2 / r 6, а Fдисп Межмолекулярное взаимодействие r -7 (здесь α1 и α2 — поляризуемости взаимодействующих молекул). М. в. данного типа называется дисперсионным потому, что Дисперсия света в веществе определяется теми же свойствами молекул, что и это взаимодействие. Дисперсионные силы действуют между всеми атомами и молекулами, так как механизм их появления не зависит от того, есть ли у молекул (атомов) постоянные дипольные моменты или нет. Обычно эти силы превосходят по величине как ориентационные, так и индукционные. Только при взаимодействии молекул с большими дипольными моментами, например молекул воды, Fор > Pдисп (в 3 раза для молекул воды). При взаимодействии же таких полярных молекул, как CO, HI, HBr и других, дисперсионные силы в десятки и сотни раз превосходят все остальные. Очень существенно, что все три типа М. в. одинаковым образом убывают с расстоянием:
U = Uop + Uинд + Uдисп Межмолекулярное взаимодействие r- -6.
Силы отталкивания действуют между молекулами на очень малых расстояниях, когда приходят в соприкосновение заполненные электронные оболочки атомов, входящих в состав молекул. Существующий в квантовой механике Паули принцип запрещает проникновение заполненных электронных оболочек друг в друга. Возникающие при этом силы отталкивания зависят в большей степени, чем силы притяжения, от индивидуальности молекул. К хорошему согласию с данными экспериментов приводит допущение, что потенциальная энергия сил отталкивания Uот возрастает с уменьшением расстояния по закону Uот(r)Межмолекулярное взаимодействие r -12, a Fот Межмолекулярное взаимодействие r -13.
Если принять, что U(r) = 0 при r →∞, иучесть, чтоэнергияпритяженияубываетсуменьшениемрасстоянияпропорционально r -6, а энергия отталкивания растет как r -12, то кривая U(r) будет иметь вид, изображенный на рис. 2. Минимуму потенциальной энергии соответствует расстояние, на котором силы взаимодействия молекул равны нулю.
Рассчитать с достаточной точностью U(r) на основе квантовой механики при огромном разнообразии пар взаимодействующих молекул практически нельзя. Не удаётся пока и экспериментально измерить силу взаимодействия на межмолекулярных расстояниях. Поэтому обычно подбирают такую формулу для U(r), чтобы проделанные с её помощью расчёты хорошо бы согласовались с экспериментом. Наиболее часто пользуются формулой
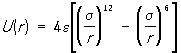
так называемым потенциалом Леннарда-Джонса. Входящие в формулу величины σ и ε определяются экспериментально на основе зависимости свойств веществ (например, коэффициенты диффузии, теплопроводности или вязкости) от σ и ε.
Лит.: Радченко И. В., Молекулярная физика, М., 1965; Коулсон К., Межатомные силы — от Максвелла до Шредингера, «Успехи физических наук», 1963, т. 81, в. 3; Гиршфельдер Дж., Кертисс Ч., Берд Р., Молекулярная теория газов и жидкостей, перевод с английского, М., 1961.
Г. Я. Мякишев.
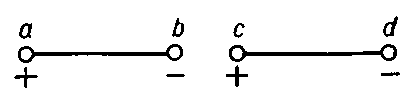
Рис. 1. Два электрических диполя ab и cd при указанном взаимном расположении притягиваются, т. к. разноимённые заряды в точках b и с взаимодействуют сильнее, чем одноимённые заряды в точках а и с (а также в b и d).
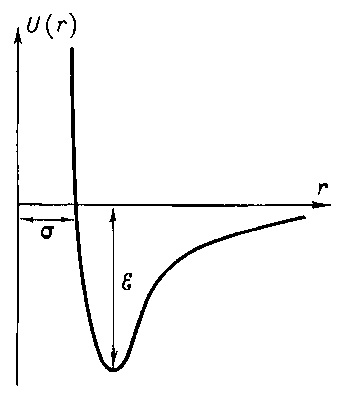
Рис. 2. Зависимость потенциала U(r) межмолекулярного взаимодействия Леннарда-Джонса от расстояния r между молекулами. Расстояние r = σ — наименьшее возможное расстояние между неподвижными молекулами, ε — глубина «потенциальной ямы» (энергия связи молекул).
Силы межмолекулярного действия, их природа и свойства.
Коллоидная химия
