II. Изучение скорости разложения пероксида водорода газометрическим методом
Распад пероксида водорода в водном растворе Н2О2 = = Н2О + 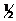 О2 – пример гомогенной каталитической реакции, ускоряемый ионамиCrО42–, Cr2О72–, WО42–, МоО42–, Fe2+, Fe3+и др. Указанные ионы образуют с пероксидом водорода промежуточные соединения, которые распадаются с выделением кислорода; последним процессом определяется кинетика всей реакции. В ряде случаев удалось выделить промежуточные продукты гомогенного каталитического распада пероксида водорода, разлагаемые по мономолекулярному или бимолекулярному путям. Так, при катализе ионом CrО42–могут образоваться активные промежуточные формы CrО62–и CrО52–. Порядок реакции увеличивается с ростом температуры.
О2 – пример гомогенной каталитической реакции, ускоряемый ионамиCrО42–, Cr2О72–, WО42–, МоО42–, Fe2+, Fe3+и др. Указанные ионы образуют с пероксидом водорода промежуточные соединения, которые распадаются с выделением кислорода; последним процессом определяется кинетика всей реакции. В ряде случаев удалось выделить промежуточные продукты гомогенного каталитического распада пероксида водорода, разлагаемые по мономолекулярному или бимолекулярному путям. Так, при катализе ионом CrО42–могут образоваться активные промежуточные формы CrО62–и CrО52–. Порядок реакции увеличивается с ростом температуры.
CrО62– = CrО42– + О2 мономолекулярный распад.
2CrО52– = 2 CrО42– + О2 бимолекулярный распад.
В реакционный сосуд 1 налейте 8 мл раствора катализатора 0,25н К2СrO4 и поместите его в термостат 4 (рис.4.5). Уровень воды в бюретке 2 установите на нулевом делении или около него. Проверьте прибор на герметичность. После 10 мин. термостатирования при заданной температуре в реакционный сосуд прилейте 0,5 мл Н2О2 (20%). Раствор перемешайте встряхиванием, реакционный сосуд закройте пробкой и поставьте в термостат. Кран вверху бюретки держите открытым около 1 мин (для вытеснения воздуха), затем его закройте. Установите одинаковые уровни воды в бюретке и уравнительном сосуде 3, чтобы привести давление в приборе к атмосферному.
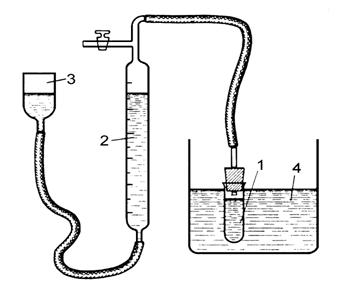
Рис.4.5. Схема установки для изучения скорости
разложения H2O2 газометрическим методом
Запишите уровень воды в бюретке и отметьте время. Далее отмечайте время от начала реакции, за которое вытесняется 1 мл воды в бюретке, приводя давление в приборе к атмосферному при каждом измерении. Данные занесите в таблицу.
Уравнение реакции Н2О2 = Н2О + 1/2 О2
Температура опыта _________________
Катализатор _______________________
| № изм. | Время от начала реакции в с. │ в мин. | Объем выделившегося газа, V t | V¥ – V t | lg(V¥ – V t) |
Включите водяную баню. После двенадцати-четырнадцати замеров реакционный сосуд поместите в нее и держите до полного разложения Н2О2. Далее реакционный сосуд перенесите в термостат, выдержите в нем несколько минут для охлаждения до температуры термостата и при равенстве уровней воды в бюретке и уравнительном сосуде замерьте уровень воды в бюретке и запишите в таблицу.
1. По опытным данным постройте график зависимости логарифма разности объемов кислорода от времени
lg(V¥ – Vt ) = f(t),
где V¥– объем кислорода, выделившегося при полном разложении Н2О2 (определяется как разность уровней в бюретке в момент, принятый за начало реакции, и после кипячения Н2О2 до полного разложения).
На оси абсцисс откладывайте время в минутах. Сделайте вывод о порядке реакции.
2. Произведите расчет величины константы скорости реакции графически по
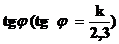
и по кинетическому уравнению реакции первого порядка, где концентрации заменяются величинами им пропорциональными, т.е. разностью объемов кислорода при tв районе 6‑го – 7-го измерений (если реакция 1 порядка)
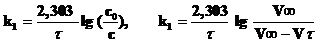 .
.
3. Зная константу скорости, вычислите энергию активации в Дж·моль–1 по уравнению
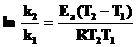 , R = 8,314 Дж·К–1·моль–1.
, R = 8,314 Дж·К–1·моль–1.
Значения k2 и T2 спросите у преподавателя.
4. Рассчитайте предэкспоненциальный фактор из уравнения Аррениуса:
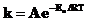 или
или 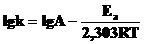 .
.
Работа должна содержать график lg(V¥ – Vt) =f (t), подробные расчеты k, Ea, А.
