Влияние концентрации. Порядок реакции
Поскольку скорость реакции определяется числом актов взаимодействия в единицу времени, она, очевидно, должна зависеть от концентрации реагирующих веществ. Теоретические и экспериментальные данные показывают, что для элементарных актов эта зависимость имеет следующий характер: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов.
Для обратимой элементарной гомогенной реакции
Н2 + I2 =2НI
скорости прямой и обратной реакций соответственно равны
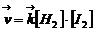
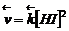 (4.1)
(4.1)
Здесь в квадратных скобках стоят мгновенные молярные концентрации реагирующих веществ, а коэффициент k называется константой скорости реакции, зависящей только от природы реагентов и температуры. Численно константа kравна скорости в условиях, когда концентрации каждого из реагирующих веществ равны единице. Зависимость, описываемая уравнениями (4.1), называется законом действующих масс (ЗДМ). В случае гетерогенной реакции:
S(т) + О2(г) = SO2(г)
в уравнение ЗДМ входят лишь концентрации газообразных реагентов. Концентрация твердофазного вещества в первом приближении считается постоянной и входит в константу скорости, т.о. v = k [O2].
Все сказанное выше относится к элементарным реакциям, стехиометрическое уравнение которых отражает их механизм.
Однако, как правило, реакции протекают сложным путем через многостадийные процессы, продукты которых быстро расходуются. В этих случаях стехиометрическое уравнение реакций фиксирует только начальное и конечное состояние системы и ничего не говорит о механизме процесса.
Обычно зависимость скорости реакции от концентрации описывается кинетическим уравнением:
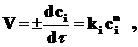 (4.2)
(4.2)
где ci – концентрация вещества;
n – порядок реакции по веществу i.
Формальным порядком реакции называется показатель степени в кинетическом уравнении реакции, определяемый экспериментально.
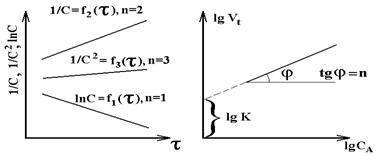
Используя логарифмическую форму кинетического уравнения V = k·cn (lg V = lg k + n·lgc) из линейной зависимости (рис. 4.1.б) получаем lg k и n = tg j.
Кроме того порядок реакции может быть определён следующим способом:
Интегрируя кинетические уравнения для реакций первого, второго и третьего порядков, получаем выражения для констант скоростей в виде функций от времени (t) и концентрации реагирующего вещества, соответствующей этому времени. Так, для реакции первого порядка (n = 1):
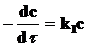 .
.
а) б)
Рис.4.1. Изменение функции концентрации исходных веществ во времени для реакций различных порядков (а); зависимость логарифма скорости реакции от логарифма концентрации исходных веществ (б).
Разделим переменные и проинтегрируем
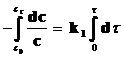 .
.
После интегрирования и преобразования получим выражение
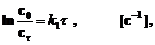
где c0 – начальная концентрация. Выражения для констант скоростей реакций второго и третьего порядков имеют вид:
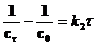 , [л×моль–1×с–1] , [л×моль–1×с–1] | |
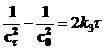 , [л2×моль–2×с–1] , [л2×моль–2×с–1] |
Получив экспериментально каким-либо методом набор значений ci для ti, можно легко проверить, уравнением какого порядка описывается формальная кинетика реакции (рис.4.1а).
Одним из методов определения порядка реакции является метод избытка реагента. Он заключается в том, что для процесса описываемого уравнением аА+вВ→dDизучают сначала порядок реакции по веществу А, для чего берут в большом избытке вещество В(св= const) и прослеживают, как меняется скорость реакции с изменением сА: VA=kcAn. Аналогично определяют порядок реакции по веществу В , беря избыток вещества А. Тогда VB=KcBe. Отсюда V=KcAh*cBL=Kcn , где n – общий порядок реакции n = h + l.
Порядок реакции может быть целым, дробным или нулевым.
Для реакции Н2 + I2 ® 2НI общий порядок реакции равен двум. Однако при условии [H2] >> [I2] скорость реакции определяется изменением [I2], ибо концентрация водорода практически стационарна и подчиняется кинетическому уравнению первого порядка
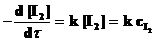 .
.
Молекулярность реакции.
Типы химических реакций
Число молекул, принимающих участие в элементарном акте химического превращения, называется молекулярностью. Различают реакции одно-, двух- и трехмолекулярные. Вероятность одновременного соударения многих частиц очень мала, поэтому трехмолекулярные реакции редки, а четырехмолекулярные неизвестны. Поскольку в обычном случае уравнение химической реакции фиксирует начальное и конечное состояние системы, формальное значение молекулярности, определяемое суммой стехиометрических коэффициентов в уравнениях вида (4.3), бывает большим и не всегда совпадающим с общим порядком реакции, т.е. а + в >> n. Объясняется это тем, что стехиометрическое уравнение реакции описывает процесс в целом и не отражает истинного механизма реакции, протекающей, как правило, сложным путем.
Например, стехиометрическое уравнение реакции разложения оксида азота (V) соответствует реакции второго порядка:
2N2O5 = 4NO2 + O2.
Однако исследование показывает, что реакция подчиняется уравнению первого порядка. Это противоречие устраняется при рассмотрении истинного механизма реакции, который определяется двумя последовательными превращениями:
N2O5 = N2O3 + O2,
N2O5 + N2O3 = 4NO2.
Наиболее медленной является первая стадия, которая определяет общую скорость и порядок реакции, равный единице.
Порядок и молекулярность реакции могут не совпадать также в тех случаях, когда по условиям эксперимента различие концентраций реагентов весьма велико. Так, в реакции гидролиза
NH4CN + H2O = HCN + NH4OH,
протекающей при большом избытке воды, можно считать [H2O] = сonst. Тогда порядок этой бимолекулярной реакции будет равен единице.
Можно сказать, что порядок и молекулярность реакции будут совпадать лишь для простых реакций, протекающих в одну стадию в соответствии со стехиометрическим уравнением.
По механизму протекания сложные реакции подразделяются на несколько типов. Рассмотрим важнейшие из них.
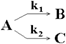 Реакции называются параллельными, если исходные вещества одновременно реагируют в нескольких направлениях.
Реакции называются параллельными, если исходные вещества одновременно реагируют в нескольких направлениях.
Константа скорости равна сумме констант параллельных реакций, V=k1[A]+k2[A], то есть скорость процесса определяется самой быстрой реакцией, а отношение скоростей V1/V2 = k1/k2 = const (принцип независимости химических реакций).
Последовательными являются реакции с промежуточными стадиями, т.е. продукт одной из реакций является исходным веществом для другой.
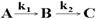 Зависимость относительной концентрации компонентов реакции
Зависимость относительной концентрации компонентов реакции
от времени представлена на рис. 4.2.
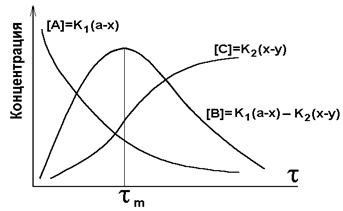
Рис.4.2. Кинетические кривые последовательных реакций
Для любых значений k1 и k2 положения максимума для [B] и точки перегиба для [C] находятся при одном и том же значении tm. При условии k1 << k2, [B]m ® 0, концентрация промежуточного продукта мала. При k1 >> k2, [B]m ® 1, все исходное вещество может превратиться в промежуточный продукт прежде, чем начнется вторая реакция. В этом случае скорость всего процесса определяется скоростью второй стадии. Константа скорости и скорость определяются самой медленной реакцией (принцип лимитирующей стадии).
Цепные реакции – радикальные реакции, в которых превращение исходных веществ в продукты осуществляется путем многократного чередования элементарных актов с участием свободных радикалов или атомов.
К цепным реакциям относятся, в частности, реакции горения, полимеризации, радиационные и фотохимические. Последние осуществляются под действием квантов света с энергией 1,6 – 4 эВ.
Для цепных реакций характерны три стадии: зарождение цепи, ее развитие и обрыв. Зарождение цепи может происходить под воздействием света, нагревания, радиоактивного излучения, химического взаимодействия и др.
Примером цепной неразветвленной реакции является синтез НCl: H2 + Cl2 ® 2HCl
Реакция идет по схеме:
I. Cl2 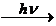 2Cl· (инициирование)
2Cl· (инициирование)
II.Cl· + H2 ® HCl + H· ( рост цепи )
H· + Cl2 = НСl + Cl· и т.д.
III. Cl· + H· = HСl(обрыв цепи).
Начало реакции связано с образованием радикалов хлора Cl·.
Цепной разветвленной реакцией является, например, реакция горения водорода: Н2 + 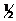 О2 = H2O .
О2 = H2O .
Окисление идет по схеме:
H2 + O2 ® H· + HO•2 (зарождение цепи )
H· + O2 ® •OH + ·O·(разветвление )
·O· + H2 ® •OH + H·(рост цепи )
•OH + H2 ®H2O + H·и т.д.
H· + •OH ®H2O(обрыв цепи )
Фотохимические реакции протекают под действием света. Каждый поглощенный квант света вызывает превращение одной молекулы (закон Эйнштейна). Количество продуктов фотохимической реакции пропорционально интенсивности падающего света и времени его воздействия на вещество (закон Гершеля и Дрепера ).
Различают два вида фотохимических реакций.
В одних реакциях поглощение света играет роль только возбудителя реакции, которая дальше совершается самопроизвольно, независимо от количества поглощенного света. Например: фотоконденсация различных соединений с олефинами, протекающая по радикально-цепному механизму типа:
В других реакциях химическое взаимодействие происходит в количествах, пропорциональных количеству света, поглощенного реагирующими веществами. Например, реакция разложения галогенидов серебра в фотографическом процессе. Число молекул, прореагировавших под действием света в расчете на один поглощенный квант – квантовый выход (Ф). Для простых реакций Ф £ 1; для сложных реакций Ф > 1, что означает не отклонение от закона эквивалентности, а появление вторичных процессов.
