Определение миллиграммового содержания меди в сульфате меди
Иодометрическое определение меди основано на реакции:
2Cu2+ + 4I- = 2CuI + I2 (14)
| Сu2+ + 1ē = Cu+ | |
| 2I- - 2ē = I2 |
Молярная масса эквивалента меди равна молярной массе атома меди 63,54 г. Нормальный окислительно-восстановительный потенциал пары 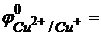 0,17 B, т.е. меньше потенциала пары
0,17 B, т.е. меньше потенциала пары 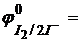 0,54 B. Однако, в этой реакции окислителем является ион Cu2+ и происходит это потому, что концентрация иона Cu+ сильно уменьшается из-за малой растворимости иодида меди (I) (ПРCuI = 10-12), в результате чего потенциал пары Cu2+/Cu+ становится больше величины 0,54 В. Если принять концентрацию иодид-иона равной 10-1 моль/л, то концентрация иона Cu+, найденная из произведения растворимости, равна:
0,54 B. Однако, в этой реакции окислителем является ион Cu2+ и происходит это потому, что концентрация иона Cu+ сильно уменьшается из-за малой растворимости иодида меди (I) (ПРCuI = 10-12), в результате чего потенциал пары Cu2+/Cu+ становится больше величины 0,54 В. Если принять концентрацию иодид-иона равной 10-1 моль/л, то концентрация иона Cu+, найденная из произведения растворимости, равна:
[Cu+] = ПР[CuI]/[I-] = 10-12/10-1 = 10-11 моль/л
Подставив эту величину в уравнение Нернста, можно найти величину потенциала пары Cu2+/Cu+:
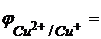 0,17 + 0,059lg([Cu2+]/10-11) = 0,808 + 0,059lg([Cu2+])
0,17 + 0,059lg([Cu2+]/10-11) = 0,808 + 0,059lg([Cu2+])
и в результате такой величины
Δ 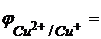 0,808 + 0,059lg[Cu2+]
0,808 + 0,059lg[Cu2+]
Δ 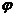 реакции (14)становится больше нуля и реакция практически протекает.
реакции (14)становится больше нуля и реакция практически протекает.
Раствор сульфата меди перед анализом нужно подкислить для подавления реакции гидролиза.
План работы
1. В мерную колбу на 100,00 мл получить подкисленный раствор сульфата меди, довести до метки водой, перемешать.
2. В две колбы для титрования отмерить мензуркой 10-15 мл 10%-ного раствора KI, подкислить несколькими каплями серной кислоты, обесцветить тиосульфатом.
3. Пипеткой прилить в колбы аликвотную часть исследуемой соли меди, закрыть пробкой или крышкой и поставить в темноту на 5 минут для завершения реакции.
4. Заполнить бюретку раствором тиосульфата натрия.
5. Титровать выделившийся иод тиосульфатом сначала до светло-желтого цвета, затем прилить в колбу 9-10 капель крахмального клейстера и продолжать титрование до исчезновения голубой окраски (остается белый осадок CuI). Записать объем V1. Таким же образом оттитровать иод во второй колбе и записать объем V2. Рассчитать среднеарифметический объем Vср(Na2S2O3).
6. Рассчитать массу меди по формуле:
 мг;
мг;
7. Показать результат преподавателю и, получив у него правильный результат (mтеор.), определить относительную ошибку анализа:
%отн. ошибки = 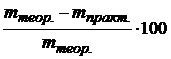
2.3. Задачи и примеры решений
1. Контрольные вопросы
1. Напишите уравнение Нернста и поясните значение всех входящих в него величин.
2. Как определить направление реакции окисления-восстановления и полноту ее протекания?
3. Выведите формулу для расчета константы равновесия реакции окисления-восстановления.
4. Какими способами фиксируется точка эквивалентности в методах окисления-восстановления? Привести конкретные примеры.
5. Как связан интервал перехода редокс-индикатора с его стандартным окислительно-восстановительным потенциалом?
6. Какие реакции называются автокаталитическими? Показать механизм автокатализа на конкретном примере.
7. Какие условия (температура, рН, скорость добавления титранта) необходимо соблюдать при титровании оксалата натрия раствором KMnO4? Дать необходимые пояснения.
8. Почему оксалат натрия является более удобным исходным веществом для установки титра KMnO4, чем щавелевая кислота?
9. Привести примеры перманганатометрического титрования: прямого, обратного и по методу замещения.
10. Как зависит величина скачка на кривой титрования в методах окисления-восстановления от концентрации исходных растворов, концентрации ионов водорода, разности стандартных потенциалов окислителя и восстановителя?
11. Какие из указанных рабочих (стандартных) растворов являются приготовленными, а какие – установленными: KMnO4, K2Cr2O7, KBrO3, I2?
12. Почему рабочие растворы KMnO4 и Na2S2O3 нельзя использовать сразу после приготовления? Что происходит с этими растворами при хранении? Привести уравнения соответствующих реакций.
13. Какие установочные вещества (первичные стандарты) используют при стандартизации растворов: а) KMnO4; б) Na2S2O3? Привести уравнения химических реакций и определить молярные массы эквивалентов.
14. В каких случаях и почему при редоксиметрических титрованиях рекомендуется нагреть анализируемый раствор?
15. Какие рабочие растворы используют при обратном титровании в методе: а) перманганатометрии; б) иодометрии? Привести примеры определений.
16. Предложить два различных метода определения MnO2 в пиролюзите. Записать уравнения химических реакций, расчетные формулы.
17. Как изменится (понизится, повысится, останется неизменной) точность перманганатометрического определения ионов Fe2+, если в раствор ввести: а) «защитную смесь»; б) избыток фторида натрия?
18. Почему реакцию окисления Cr3+ перекисью водорода выполняют в щелочной среде, а не в кислой?
19. Что представляют собой окислительно-восстановительные индикаторы? Какой химический процесс является причиной изменения их окраски?
20. Охарактеризуйте окислительно-восстановительную способность пары иод – иодид-ион.
