Изменение некоторых характеристик элементов в группе сверху вниз
*заряд ядер атомов увелич
*радиус атомов увелич
*число энер уровней атомов увел
*число эл. На внешнем слое атомов одинаково
*Электроотрицательность уменьш
*Ме св-ва увеличиваю
*НеМет св-ва уменьшаются
3.2
1) P₄ + 3KOH (конц.) + 3H₂O = 3KH₂PO₂ + PH₃ (газ)
2) 2PH₃ + 4O₂ = P₂O₅ + 3H₂O
3) P₂O₅ + 4NaOH = 2NaHPO₄ + H₂O
4) 2Na₂HPO₄ = Na₄P₂O₇ + H₂O
3.3
CaCO3 + 2HNO3 =Ca(NO3)2 + H2O + CO2
Состав конечного раствора после добавления CaCO3:
1. Н2О - она будет состоять из воды начального раствора азотной кислоты + вода образовавшияся в результате реакции
2. Ca(NO3)2 - образовавшийся в результате реакции
3. HNO3 - количество уменьшится на количество прореагировавшей с CaCO3 кислоты
Обозначим количество моль прореагировавшей кислоты через Х, концентрация кислоты в конечном растворе составляет 10/2=5%
4. Масса 1 моль HNO3=1+14+3*16=63 г
Масса 1 моль Ca(NO3)2=40+(14+3*16)*2=164 г
Масса 1 моль воды = 2*1+16=18 г
Масса 1 моль CaCO3= 40+12+3*16=100 г
5. Составим уравнение
(250*0,1-63*х) /(250+164*х/2+18*х/2-63*х=0,05
Решая уравнение получим 64,4*х=12,5, т. е. х=0,1941 моль HNO3 прореагировали в результате реакции.
По уравнению реакции количество моль CaCO3 реагирущее с 2 моль HNO3 равно 1, следовательно масса карбоната кальция, которое необходимо для получения 5% конечноного раствора азотной кислоты= 0,1941/2*100=9,705 г
Билет 4
Классификация химических соединений ,закномоерность протекания химических реакций
Тепловой эффект
Химическая реакция-разрыв связи продуктов реакции и образование новых связей в продуктах реакции
Химическая реакция- процесс превращения веществ связанных с превращением энергии, сопровождающейся образованиями новых веществ с другими свойствами
Признаки классификации
1.Число и состав исходных и образующих веществ
Соединение
Разложение
Замещение
Обмен
2. Тепловой эффект реакции
Экзотермический (выделение теплоты)
Эндотермический (поглащение теплоты
3. По степени окисления(ОВР,Не ОВР)
4. Обратимость(Обратимые и Не обратимые)
5.Наличие катализатора(Каталитические и Не каталитические)
6. По агрегатному состоянию(Гомогенные иГетерогенные)
Классификация органических соединений
Признаки:
1.По конечному результату,пример
2. По способу разрыва связей, примеры
Признаки
I.1.Присоединение СН3-СН=СН2+С12-> СН3-СНС1-СН2С1
2.замещение СН4+С12->СН3С1
3.отщепление, пример
4.перегруппировка
II.1.Гомолитический(радикальный) R
2.Гетеролитический (ионный)
Нуклеофильный N
ЭлектрофильныйE
Термохимическое уравнение
Раздел химии в котором изучается тепловой эффект реакции называется термохимией
Тепловой эффект- это теплота, которая может быть поглощена или выделена
Термохимия- Q,Термодинамика ∆H-энтальпия
Стандартной энтальпией образования вещества называется количество теплоты, которое выделяется или поглощается при образовании одного моля этого вещества из простых веществ при стандартных условиях
Тепловой эффект реакции окисления кислородом элементов, входящих в состав вещества, до образования высших оксидов называется теплотой сгорания этого вещества
Энтальпия –функция состояния
Билет 5
5.1Типы химической связи
Основные типы химической связи - ионная, ковалентная и водородная .
Ионная (электровалентая) Она образуется при взаимодействии атомов, которые сильно отличаются по электроотрицательности. В этом случае происходит переход валентных электронов от атомов с меньшей электроотрицательностью к атомам, у которых она больше. В результате такого перехода возникают два противоположно заряженных иона - катион и анион, которые взаимно притягиваются друг к другу. Наиболее типичной ионной связью является связь между металлами и галогенами. Для органических соединений наиболее характерными являются ковалентная и водородная связи.
Ковалентная (неэлектровалентная) связь - основная химическая связь в органических соединениях. Этот тип связи образуется при взаимодействии атомов, электроотрицательности которых равны или отличаются незначительно. Такая связь возникает в результате обобществления валентных электронов, которые до образования связи принадлежали двум атомам. В результате образования молекулы оба электрона становятся общими для двух ядер. Так образуется единое электронное облако - молекулярнаяорбиталь.
КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ (КНС) - образуют атомы одного и того же химического элемента - неметалла (Например, H2, O2, О3).
КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ (КПС) - образуют атомы разных неметаллов, отличающихся по значениям электроотрицательности (Например, HCl, H2O).
Водородная связь. (H-связь) Ее образование обусловлено тем, что в результате сильного смещения электронной пары от электроотрицательного атома водорода, обладающей эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20-100 кДж моль-1.
Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H2O, H2F2, NH3. За счет водородных связей вода характеризуется столь высокими по сравнению с H2Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при -100°С, а кипела при -80°С.
Металлическая связь— связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из «электронного газа». Как следствие, металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве.
Металлическая связь отличается от ковалентной также и по прочности: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Энергия связи — энергия, необходимая для разрыва химической связи во всех молекулах, составляющих один моль вещества. Энергии ковалентных и ионных связей обычно велики и составляют величины порядка 100-800 кДж/моль.МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ, взаимод. молекул между собой, не приводящее к разрыву или образованию новых хим. связей. Межмолекулярное взаимодействие определяет отличие реальных газов от идеальных, существование жидкостей и мол. кристаллов. От межмолекулярного взаимодействия зависят мн. структурные, спектральные, термодинамич., теплофиз. и др. св-ва в-в. Появление понятия межмолекулярного взаимодействия связано с именем Й. Д. Ван-дер-Ваальса, к-рый для объяснения св-в реальных газов и жидкостейпредложил в 1873 ур-ние состояния, учитывающее межмолекулярное взаимодействие (см. Ван-дер-Ваальса уравнение). Поэтому силы межмолекулярного взаимодействия часто называют ван-дер-ваальсовыми.
Виды межмолекулярного взаимодействия.Основу межмолекулярного взаимодействия составляют кулоновские силы взаимод. между электронами и ядрами одной молекулы и ядрами и электронами другой. В экспериментально определяемых св-вах в-ва проявляется усредненноевзаимод., к-рое зависит от расстояния R между молекулами, их взаимной ориентации, строения и физ. характеристик (ди-польного момента, поляризуемости и др.). При больших R, значительно превосходящих линейные размеры l самих молекул, вследствие чего электронные оболочки молекул не перекрываются, силы межмолекулярных взаимодействий можно достаточно обоснованно подразделить на три вида-электростатические, поляризационные (индукционные) и дисперсионные. Электростатич. силы иногда называют ориентационными, однако это неточно, поскольку взаимная ориентация молекул может обусловливаться также и поляризац. силами, если молекулы анизотропны
Кристаллические решетки. Атомные, молекулярные и ионные кристаллы. Зависимость физических свойств веществ от типов кристаллических решеток
В кристаллических веществах атомы, молекулы и ионы расположены упорядоченно, на определенных расстояниях. Такое закономерное расположение частиц в кристаллах называют кристаллической решеткой. Зависимости от того, какие частицы находятся в узлах этой решетки, различают ионные, атомные и молекулярные кристаллические решетки. Известны также и металлические кристаллические решетки.
Ионные кристаллические решетки характерны для соединений с ионным типом химической связи. В узлах таких решеток находятся противоположно заряженные ионы. Силы мижионнои взаимодействия являются весьма значительными, поэтому вещества с таким типом кристаллической решетки является нелетучими, твердыми, тугоплавкими, их растворы и расплавы проводят электрический ток. Типичными представителями таких соединений являются соли, например, натрия хлорид, калия нитрат и другие.
5.2При взаимодействии азота и лития образуется нитрид лития (уравнение 1), который легко разлагается водой с выделением аммиака (уравнение 2). Аммиак окисляется кислородом в присутствии платинового катализатора до оксида азота (II), не имеющего цвета (уравнение 3). Образование бурого газа NO2 из NO происходит легко и самопроизвольно (уравнение 4).
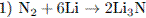
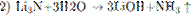
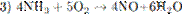
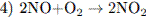
5.3
Билет 6
1.Дипольный момент – важная молекулярная константа, характеризующая электрическую симметрию молекулы.
Знание величины дипольного момента необходимо для изучения природы химической связи, оценки прочности донорно-акцепторных и межмолекулярных связей, для квантово-химических расчетов. По величине дипольного момента можно судить об изомерии и конформации органических соединений, конфигурации координационных узлов комплексов, о взаимном влиянии атомов и связей в молекуле.
Степень ионности – это реальный заряд тона в крист-й структуре.
Величина ионности может быть оценена и по разности электроотрицательностей атомов .
Насыщаемость– свойство атомов образовывать строго определенное число ковалентных связей. Благодаря насыщаемости связей молекулы имеют определенный состав.
Направленность– т. е. связь образуется в направлении максимального перекрытия электронных облаков. Относительно линии соединяющей центры атомов образующих связь различают: σ и π (рис. 9):
σ-связь – образована перекрыванием АО по линии соединяющей центры взаимодействующих атомов; π-связь – это связь, возникающая в направлении оси перпендикулярной прямой, соединяющей ядра атома.
Направленность связи обусловливает пространственную структуру молекул, т. е. их геометрическую форму.
Длинной связи d называют расстояние между центрами атомов, образующих данную связь. Экспериментальные методы позволили найти точную длину связей. Они имеют величину порядка 100 пм.
Например:
Н = 74 пм;
N2 = 110 пм;
О2 = 121 пм;
(С – С) = 154-158 пм;
(С = С) ≈ 134 пм;
(С ≡ С) ≈ 120 пм.
Определяют длину рентгеноструктурно и спектрально. Длина связи увеличивается с возрастанием атомного номера. При переходе от газов к кристаллам наблюдается увеличение длины связи, которое сопровождается её упрочнением. Длина связи позволяет также оценить жесткость связи, т.е. её сопротивляемость внешним воздействиям, вызывающем её длины.
Энергия связи
Мерой прочности связи является энергия связи. Её величина определяется работой, необходимой для разрушения связи, или выигрышем в энергии при образовании вещества из отдельных атомов.например, энергия связи Н-Н в молекуле Н2 = 435 кДж/моль (104 ккал/моль), это значит, что при образовании 1 моля Н2 выделяется 435 кДж (104 ккал).
Н + Н = Н2 + 435 кДж/моль (104 ккал/моль)
Аналогичным путем можно оценить энергию химической связи и для других двухатомных молекул.
из свободных атомов:
clip_image002
из простых веществ:
clip_image004
Эти данные позволяют оценить прочность связи:
С – С (85 ккал);
С = С (145 ккал);
С ≡ С (198 ккал).
Таким образом параметры связи – это энергия, длина, валентные углы, прочность, насыщаемость, направленность.
6.22KMnO4 + 16HBr = 2MnBr2 + 5Br2 + 8H2O + 2KBr
3Br2 + 2Fe = 2FeBr3
FeBr3 + 3CsOH = Fe(OH)3 + 3CsBr
2Fe(OH)3 = Fe2O3 + 3H2O
6.3Решение
Найдем массу селеновой кислоты в растворе:
100*0,15=15г
127*Хг------------145*Хг
SеO3+Н2О=H2SеO4
127г-------------145г
Пусть нам нужно добавить Х моль SеO3 (его масса будет 127*Х г), тогда в растворе образуется 145Х г H2SеO4. По условию нам нужно получить 30% (или 0,3 ) раствор, значит:
(15+145*Х)/(100+127*Х)=0,3
Х=0,14моль
Откуда 127*Х=17,8 г это ответ
БИЛЕТ №7
7.1.Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
Термохимические уравнения – это уравнения, в которых указан тепловой эффект (изменение энтальпии Н) реакции и физическое состояние реагентов и продуктов.
Расчеты по термохимическим уравнениям (экзотермические, эндотермические реакции, тепловой эффект)
1. Составьте термохимическое уравнение реакции горения магния, если известно, что при
2. Вычислите по термохимическому уравнению количество теплоты, выделяемой при сгорании
3. По термохимическому уравнению Вычислите массу разложившегося в-ва , если известно, что на его разложение затрачено
7.2
FeS+2HCl=FeCl2+H2S
2Н2S+3O2=2SO2+2H2O
SO2+2KOH=K2SO3+H2O
K2SO3+2KMnO4+2KOH=K2SO4+2K2MnO4+H2O в щелочной среде реакция так протекает!
7.3
CaC2 + 2H2O = Ca(OH)2 + C2H2
Ca(OH)2 + 2HBr = CaBr2 + 2H2O
n(CaC2) = 6,4/64 = 0,1 моль.
m(HBrчистого) = V*p*w = 87*1,12*0,20 = 19,49 г.
Изуравненияреакцииследует, что n(CaC2) = n(Ca(OH)2) = n(C2H2), атакжечто n(HBrпрореагировавшего) = 2n(Ca(OH)2) = 0,2 моль.
Тогда
m(HBr прореагировавшего) = n*Mr = 0,2*81 = 16,20 г.
m(HBr осталось) = 19,49 - 16,20 = 3,29 г.
m(C2H2) = n*Mr = 0,1*26 = 2,6 г.
m(полученного раствора) = m(раствора кислоты) + m(CaC2) - m(C2H2) = 87*1,12 + 6,4 - 2,6 = 101,24 г.
w(HBr оставшегося) = (3,29/101,24)*100% = 3,25%.
Ответ: массовая доля бромоводорода в образовавшемся растворе составляет 3,25%.
Билет 8
8.1 Тепловой эффект реакции,теплота, выделенная или поглощенная термодинамической системой при протекании в ней химической реакции. Определяется при условии, что система не совершает никакой работы (кроме возможной работы расширения), а температуры реагентов и продуктов равны. Поскольку теплота не является функцией состояния, т.е. при переходе между состояниями зависит от пути перехода, то в общем случае тепловой эффект реакции не может служить характеристикой конкретной реакции. В двух случаях бесконечно малое количество теплоты (элементарная теплота) dQ совпадает с полным дифференциалом функции состояния: при постоянстве объема dQ = = dU (U-внутренняя энергия системы), а при постоянстве давления dQ = dH (H-энтальпия системы).
Термохимические уравнения реакций - это уравнения, в которых около символов химических соединений указываются агрегатные состояния этих соединений или кристаллографическая модификация и в правой части уравнения указываются численные значения тепловых эффектов.Алгоритм расчетов по химическим уравнениям
1.Составить уравнение химической реакции.
2.Над формулами веществ записать известные и неизвестные величины с соответствующими единицами измерения (только для чистых веществ, без примесей). Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала нужно определить содержание чистого вещества.
3.Под формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
4.Составить и решить пропорцию.
5.Записать ответ.
8.2
FeS+2HCl=FeCl2+H2S
2Н2S+3O2=2SO2+2H2O
SO2+2KOH=K2SO3+H2O
K2SO3+2KMnO4+2KOH=K2SO4+2K2MnO4+H2O
8.3

БИЛЕТ№9
9.1Химическая кинетика –это раздел химии ,в котором изучается скорость и механизм хим.реакции.Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Скорость гомог.р-ции-изменение кол-ва вещества ,вступившего или образующего в результате реакции за единицу времени в единице объема системы. Скорость гет-ой р-ции-изменение кол-ва в-ва за единицу времени на единицу поверхностного раздела фаз
З-н действующих масс– скорость хим.р-ции пропорционально произведению концентрации реагирующих в-в.
Правило Вант-Гоффа — При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза.
Катализизменение скорости химической реакции при воздействии веществ (катализаторов), которые участвуют в реакции, но не входят в состав продуктов. Катализатор не находится в стехиометрич. отношениях с продуктами и регенерируется после каждого цикла превращения реагентов в продукты
9.2
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4
2Fe(OH)3 =(t)= Fe2O3 + 3H2O
Fe2O3 + 6HCl = 2FeCi3 + 3H2O
9.3
Билет 10
10.1Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
2KClO 3 = 2KCl + 3O 2 ↑
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ – состояние химической системы, при котором возможны реакции, идущие с равными скоростями в противоположных направлениях. При химическом равновесии концентрации реагентов, температура и другие параметры системы не изменяются со временем. Необратимые и обратимые реакции.
Константа химического равновесия — характеристика химической реакции, по значению которой можно судить о направлении процесса при исходном соотношении концентраций реагирующих веществ, о максимально возможном выходе продукта реакции при тех или иных условиях.
Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменять температуру, давление, концентрации веществ), то положение равновесия смещается в такую сторону, чтобы ослабить внешнее воздействие.
