Растворимость стероидов.( для общего развития, что бы было о чем поболтать(
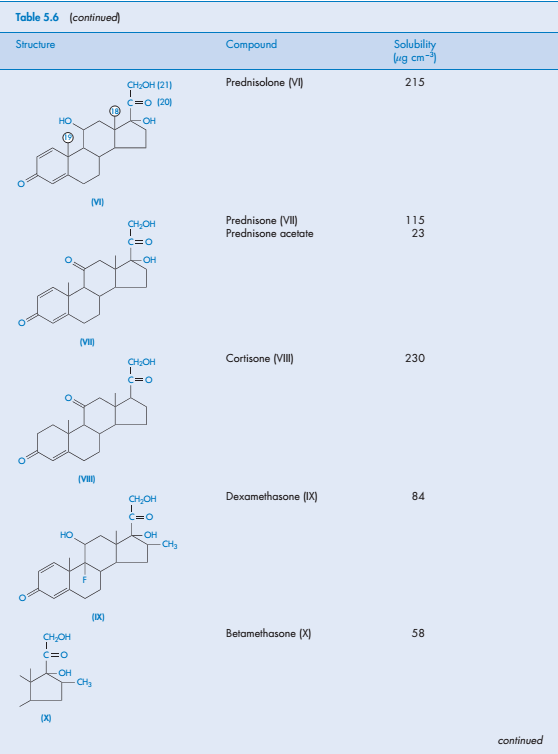
Стероиды как отдельная группа соединений, как правило, слабо растворимы в воде. Трудности растворения отчасти связаны с их сложной структурой, но для подобных стероидов можно определить значение растворимости. В таблице 5.6 приведены данные о растворимости 14 стероидов.
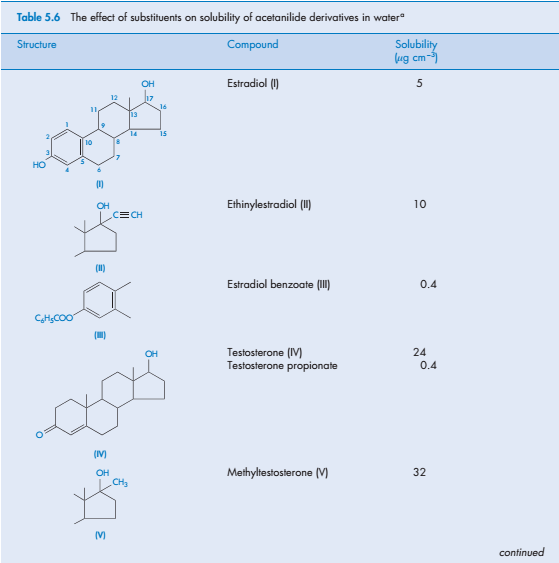
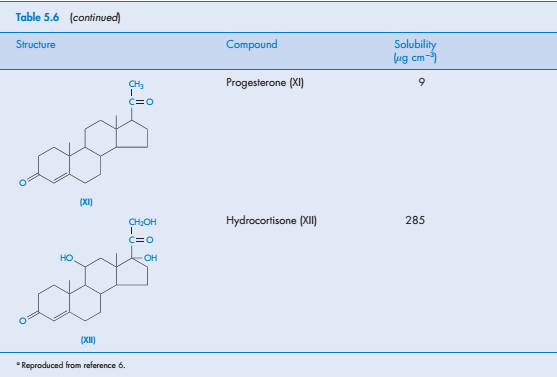
Например, наличие этильной группы повышает растворимость молекулы эстрадиола, чего и следовало ожидать. Эстрадиола бензоат, в структуре которого ОН-группа находится в 3-ем положении, растворим гораздо хуже, чем исходная молекула эстрадиола, из-за отсутствия гидроксильной группы и наличия гидрофобных групп. То же самое наблюдается в случае тестостерона и тестостерона пропионата. Эстрадиола бензоат и тестостерона пропионат обладают липофильными свойствами, благодаря чему их используют как вспомогательные вещества в растворах касторового и кунжутного масла для внутримышечного и подкожного введения (см. главу 9).
Можно предположить, что метилтестостерон менее растворим в воде, чем тестостерон, но на самом деле это не так; это вновь показывает влияние кристаллической структуры на растворимость. Метильная группа обуславливает большую растворимость благодаря меньшему значению теплоты плавления, следовательно, в твёрдом состоянии вещество лучше «распадается» при растворении.
Структурные изомеры дексаметазон и бетаметазон являются фтор-производных метилпреднизолона, но их растворимость различна, что определяется их кристаллической структурой или свойствами растворителя. Типичным примером является различия в растворимости о- , м-, п- изомеров дигидроксибензола (см.выше). В случае дексаметазона это может быть объяснено стерическом эффектом, то есть 17-ОН-группа более труднодоступна для молекул воды, чем в бетаметазоне.
Гидратация и сольватация
Состояние, в котором находится молекула при взаимодействии с водным растворителем, крайне важно для определения сродства к растворителю. Заряженные группы и электролиты активно взаимодействуют с молекулами воды, а неэлектролиты также, как и неполярные группы и молекулы углеводородов, не изменяют свою структуру при взаимодействии с водой.
Гидратация неэлектролитов
Растворимость - это основной термин, используемый в описании процесса связывания растворителя с молекулами растворенного вещества. Если растворитель - вода, то процесс называется гидратацией. В растворе сахарозы шесть молекул воды связываются c каждой молекулой сахарозы с такой аксиальностью, что вода и сахароза двигаются в растворе как одно целое, и поэтому степень гидратации может быть измерена гидродинамической техникой.
Химически очень простые молекулы, такие как маннитол, сорбитол и инозитол, имеют очень разное сродство к воде. Растворимость сорбитола в воде составляет 3,5 от того времени, что необходимо маннитолу.
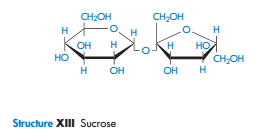
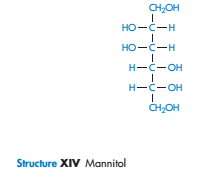
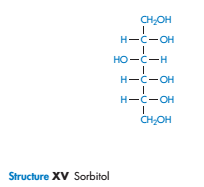
Наиболее благоприятные условиягидратации происходят, когда есть экваториальная ОН- группа на пиранозе сахара. Как полагают, это происходит из-за совместимости экваториальной -ОН с организованной структуре воды в объеме. Аксиальные гидроксильные группы не могут связываться на решетку воды, не вызывая значительных искажений. Это может быть одним из объяснений различий, хотя также могут способствовать различия в энергиях решетки кристаллов.
Гидратация ионных частиц: разрушители структуры воды и создающие структуру
Изучение растворимости ионов сложно, но оно актуально в фармацевтике, потому что эффект ионов имеется в растворимости других частиц. Силы между катионами и молекулами воды настолько сильны, что катионы могут сохранять слой молекул воды в их кристаллах. Эффект ионов на структуре воды сложен и вариабилен. Все ионы в воде обладают слоем плотно связанной воды - молекулы воды, будучи направленно ориентированными. Четыре молекулы воды в связанном слое большинства одновалентных, одноатомных ионов. Плотно удерживаемый слой можно рассматривать как «ледяное» состояние вокруг позитивных ионов. Молекулы воды могут быть ориентированы со всеми атомами водорода молекул воды, развернутых наружу (рис. 5.2).
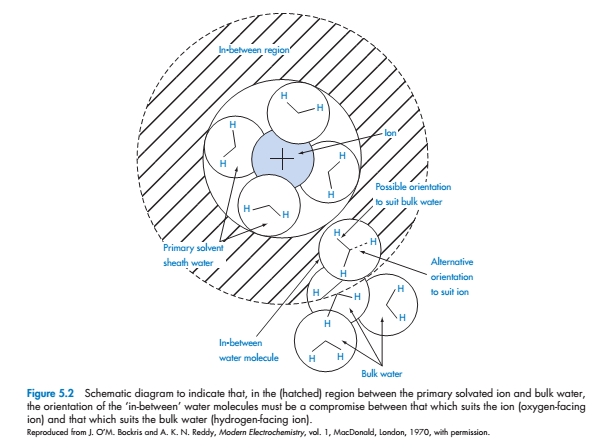
Потому что их ориентация зависит от размера иона, все они не могут участвовать в нормальном тетраэдрическом строении массы воды.
Для этого две молекулы воды должны быть ориентированы с водородами молекул воды в сторону ионов. Потом неизбежно с катионами и множеством маленьких анионов, где, как правило, есть слой воды вокруг связанного слоя, который менее упорядочен, чем масса воды. Такие ионы, которые включают в себя все щелочные и галогеновые ионы, например, литий и фтор называются разрушителями структур. Важен размер иона, так как площадь поверхности иона определяет ограничения на поляризуемость молекул воды. Много многовалентных ионов, например, алюминий 3+, увеличивают структурированную природу воды за пределами слоя гидратации.
Числа гидратации
Число гидратации, или координационное число,—это число молекул воды, непосредственно входящих в первую гидратную сферу иона данного вида. Для определения чисел гидратации применяют различные экспериментальные методы.
Числа гидратации (количество молекул воды в первичном слое гидратации) могут быть определены различными физическими методами (например, сжимаемостью), а полученные значения имеют тенденцию отличаться в зависимости от используемого метода. Общее общее действие иона на воду можно концептуально заменить сильным связыванием между ионом и некоторым эффективным числом (числом сольватации) молекул растворителя; Это эффективное число может быть почти нулевым в случае больших ионов, таких как иодид, ионы цезия и тетраалкиламмония. Числа сольватации уменьшаются с увеличением ионного радиуса, поскольку ионное силовое поле уменьшается с увеличением радиуса, и, следовательно, молекулы воды менее склонны абстрагироваться от своего положения в объемной воде.
Среди других методов упомянем метод, основанный на измерении ЭДС, возникающей при ультразвуковых колебаниях. Дебай показал, что при воздействии ультразвука на раствор электролита на электродах, погруженных в. этот раствор, возникает разность потенциалов, пропорциональная разности^ эффективных масс катионов и анионов. Последние складываются из атомных масс ионов и массы воды в гидратах.
Физико-химические методы определения чисел гидратации; дают значения, сильно отличающиеся друг от друга. Например, для иона натрия найденное число гидратации колеблется от 1 до 71. Лучшая сходимость наблюдается для ионов с большой^ атомной массой. Различие в значениях чисел гидратации является следствием влияния вторичной гидратации на конечные результаты.
Современные физические методы позволяют получить зна чения чисел гидратации с большей надежностью. Методами ЯМР и изотопного разбавления установлено, что число гидратации ионов Сr3+, Аl3+ и Mg2+ равно 6, а у Ве2+ — 4. Изучение рас сеивания рентгеновских лучей приводит к заключению, чтс ионы Li+ и К+ координируют по 4 молекулы воды. Интерпре тация электронных спектров поглощения, выполненная на основе теории кристаллического поля, показывает, что аквакомп-лексы N2+, Со2+, Fe3+, Мn2+ и Fe2+ имеют конфигурацию почти правильного октаэдра, и, следовательно, их числа гидратации равны 6.
Гидрофобная гидратация
Вода динамически связана с неполярными группами, но только в редких случаях (когда могут образовываться кристаллические клатраты) эта вода может выделяться вместе с гидрофобными группами. Фраза «гидрофобная гидратация» используется для описания этого слоя воды. Движение молекул воды замедляется вблизи неполярных групп. Гидрофобные группы индуцируют образование структуры в воде, следовательно, отрицательная энтропия (-ΔS) их растворения в воде и положительная энтропия (+ ΔS), полученные при их удалении. При обсуждении гидрофобного связывания (раздел 6.3.1) и неполярных взаимодействий эта специальная связь между водными и углеводородными цепями разработана.
