Влияние природы реагирующих веществ.
Вещества с ионными и полярными ковалентными связями в водных растворах взаимодействуют с большей скоростью. Это объясняется тем, что такие вещества в растворах образуют ионы, которые легко взаимодействуют друг с другом.
NaCl + AgNO3 = AgCl¯ + NaNO3
Cl– + Ag+ = AgCl¯
Вещества с неполярными ковалентной связью взаимодействуют с различной скоростью. Это зависит от их химической активности.
H2 + F2 = 2HF – протекает очень быстро, со взрывом, при комнатной температуре;
H2 + Br2 = 2HBr – протекает медленно, даже при нагревании.
Зависимость скорости реакции от концентрации
Условием химического взаимодействия является результативность соударения частиц (молекул), очевидно, чем больше концентрация молекул, тем больше вероятность их столкновений, а следовательно и выше скорость реакции.
Эта зависимость, скорости химической реакции от концентрации реагирующих веществ, называется законом действия масс и является основным законом химической кинетики.
Он формулируется следующим образом: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам.
Для реакции аА + bВ ® cС + dD
Согласно закону действия масс, скорость превращения по исходным веществам равна
V = k[A]а[В]b,
где k – константа скорости реакции (учитывает эффективность соударений, т.к. не каждое соударение заканчивается образованием молекул); [A] и [[B] -концентрации исходных веществ А и В.
Константа скорости k – это скорость реакции при концентрациях реагирующих веществ, равных единице.
Константа скорости зависит от температуры, но при постоянной температуре она не зависит от концентраций.
Закону действующих масс подчиняются гомогенные реакции.
Пример. N2 (г) + 3H2 (г) = 2NH3 (г) V = k[N2] [H2]3
Для выражения скорости реакции гетерогенных реакций учитывают концентрации газов и жидких веществ. Концентрации твердых веществ в кинетическое уравнение не входят.
Пример. Fe2O3 (тв.) + 3H2 (г) = 2Fe + 3H2O(г) V = k[H2]3
Зависимость скорости реакции от температуры
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа, который экспериментально установил, что
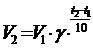 |
При повышении температуры на каждые 10 оС скорость реакции увеличивается примерно в 2 – 4 раза
где V1 и V2 скорость реакции при температуре t1 и t2 (t2 > t1), g – температурный коэффициент скорости реакции.
Пример. Во сколько раз нужно увеличить скорость химической реакции, при повышении температуры от 10 до 40 оС, если g = 3
Решение.
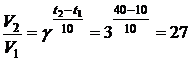
Скорость химической реакции увеличится в 27 раз.
Теория активации Аррениуса
Большинство соударений молекул не приводит к химическому взаимодействию – cтолкнувшись, они разлетаются в разные стороны, как упругие шары. Для осуществления элементарного акта реакции необходимо, чтобы электронные оболочки атомов реагентов при соударении вторгались одна в другую, преодолевая взаимное отталкивание. Это вызовет разрыв старых связей и возникновение новых. Но для этого нужно затратить энергию. Поэтому
В реакцию вступают не все молекулы, а лишь те, которые могут преодолеть энергетический барьер отталкивания и войти в химический контакт друг с другом. Такие молекулы являются активными, а избыточная энергия, которой они обладают по сравнению с молекулами, имеющими средний запас энергии, является энергией активации Еакт. С увеличением температуры растет число активных молекул и следовательно, возрастает скорость химической реакции.
При столкновении частиц образуется группировка в состоянии перераспределения связей, которая называется активированным комплексом.
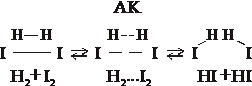
Переход системы из исходного состояния в конечное через активированный комплекс показан на рисунке.
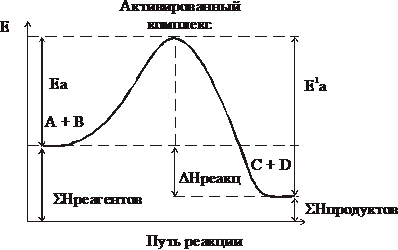
Е1а – энергия активации обратимой реакции
Е1а – Еа = DН, где DН – тепловой эффект реакции
Еакт энергией активации характеризует высоту энергетического барьера, преодолев который молекулы подвергаются химическим превращениям:
А + В = AB.
Активация молекул возможна при нагревании  или растворении вещества, при различных облучениях.
или растворении вещества, при различных облучениях.
Зависимость константы скорости реакции от энергии активации и температуры выражается формулой Аррениуса:
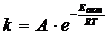
где А – постоянный множитель, не зависящий от температуры, Еакт – энергия активации, R – универсальная газовая постоянная.
Энергия активизации равна разности между средней энергией реагентов и энергией активированного комплекса.
Энергия активизации определяет влияние на скорость реакции природы реагентов.
Влияние катализатора
Катализ это явление изменения скорости реакции в присутствии катализаторов, веществ изменяющих пути протекания реакций в циклах промежуточного взаимодействия с реагентами и восстанавливающих в итоге свой состав.
Катализаторы бывают положительные и отрицательные.
Положительные катализаторы (платина, оксид марганца (IV)) ускоряют реакцию в несколько раз.
MnO2
2H2O2 ® 2H2O + O2
Отрицательные катлизаторы – ингибиторы, наоборот замеляют скорость химической реакции (пример использование ингибиторов для борьбы с коррозией нефтепроводов)
Различают гомогенный и гетерогенный катализ.
Если катализатор и реагенты находятся в одной фазе и процесс протекает в объеме, то это гомогенный катализ.
Если катализатор и реагенты находятся в разных фазах и процесс протекает на поверхности их раздела, то это гетерогенный катализ.
Механизм действия катализаторов объясняется образованием промежуточных соединений и заключается в снижении энергии активации при образовании активированного комплекса.
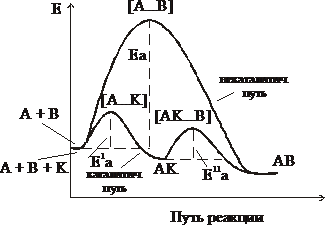
Для реакции А + B ® AB
A + К ® AК
AК + B ® AB + К
А + B ® AB
Катализатор ускоряет реакцию, хотя и не входит в ее продукты. Химическое состояние катализатора и его количество после реакции остается неизменным.
Механизм химических реакций
Реакции можно классифицировать по механизму их протекания. Они делятся на:
– простые (молекулярные) реакции, протекающие непосредственно между молекулами.
Молекулярность реакции определяется числом молекул, участвующих в элементарном акте превращения. Бывают реакции одномолекулярные, двухмолекулярные и трехмолекулярные:
одномолекулярная (мономолекулярная) СаСО3 ® СаО + СО2
двухмолекулярная (бимолекулярная) 2HI ® H2 + I2
трехмолекулярная (тримолекулярная) 2NO + H2 ® NO2 + H2O
Еакт энергия активации таких реакций составляет 120 – 440 кДж/моль
– ионные реакции, протекающие при растворении веществ.
Cl– + Ag+ = AgCl¯ Еакт = 0 – 80 кДж/моль
– радикальные (цепные) реакции с участием свободных радикалов имеющих ненасыщенные валентности.
H2 + Сl2 ® 2HCl
Обычное уравнение реакции не отражает истинный механизм данной реакции. Галогены уже при температуре 20 оС на свету образуют радикалы (ион, содержащий один неспаренный электрон)
hn
Сl2 ® 2Cl· радикал реагирует с водородом
hn
H2 + Сl· ® HCl + H·
hn
Сl2 + H· ® HCl + Cl· 1 квант света вызывает образование 100 тыс. молекул HCl
Реакция носит цепной характер, закон действия масс не соблюдается, т.к. энергия активации радикала и энергия активации взаимодействия радикала с водородом исключительно мала.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Все химические реакции делятся на необратимые и обратимые.
Необратимые реакции протекают до конца (в одном направлении).
BaCl2 + H2SO4 ® BaSO4¯ + 2HCl
Признаки необратимых реакций:
1. выпадение осадка или образование газа;
2. образование малодиссоциирующих продуктов;
3. выделение большого количества энергии.
Обратимые реакции протекают в прямом и обратном направлениях.
СО2+Н2О  СО2+Н2
СО2+Н2
3H2+N2  2NH3
2NH3
Реакцию, протекающую в правую сторону (®), называют прямой, а в левую () – обратной.
С течением времени скорость прямой реакции уменьшается, и через некоторый промежуток времени наступает химическое равновесие, когда скорости прямой и обратной реакции равны.
Для реакции общего вида
аА + вВ 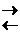 сС + dD,
сС + dD,
где А и В – исходные вещества, а и в – стехиометрические коэффициенты скорости прямой и обратной реакции по закону действующих масс будут равны
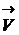 =
= 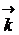 [A]a [B]b и
[A]a [B]b и 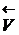 =
= 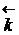 [C]c [D]d
[C]c [D]d
В условиях равновесия 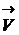 =
= 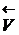 и
и 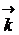 [A]a [B]b =
[A]a [B]b = 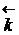 [C]c [D]
[C]c [D]
Преобразуем равенство в 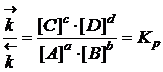
Величина Кр называется константой равновесия. Константа равновесия зависит только от температуры, и не зависит от концентрации реагирующих веществ. Присутствие катализатора тоже не влияет на нее.
Химическое равновесие, т.е. равенство скоростей прямой и обратной реакций, сохраняется до тех пор, пока сохраняются условия равновесия. При изменении условий, например температуры, или давления, или концентрации веществ, изменяются скорости прямой и обратной реакций, что ведет к нарушению равновесия и смещению (сдвигу) его в правую или левую сторону.
Направление смещения равновесия определяется принципом Ле Шателье:
если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то состояние равновесия смещается в том направлении, которое ослабляет влияние этого воздействия (или в системе усиливаются процессы, направленные на компенсацию внешнего воздействия).
На сдвиг равновесия могут влиять температура, концентрации реагентов и давление.
2. Факторы, влияющие на положение химического равновесия – температура, концентрация, давление.
