Алкеновая (ненасыщенная) кислота
Олеиновая кислота С17Н33–СООН
Алкадиеновая кислота
Линолевая кислота С17Н31–СООН
Алкатриеновая кислота
Линоленовая кислота С17Н29–СООН
Физические свойства
По агрегатному состоянию жиры подразделяются на жидкие и твёрдые (при комнатной температуре). Твёрдые жиры, как правило, образованы предельными кислотами. Жидкие жиры (их часто называют маслами) образованы непредельными кислотами.
Жиры растворимы в органических растворителях и нерастворимы в воде.
Химические свойства
1. Гидролиз или омыление жиров происходит под действием воды (обратимо) или под действием щелочей (необратимо):
а) кислотный гидролиз жиров
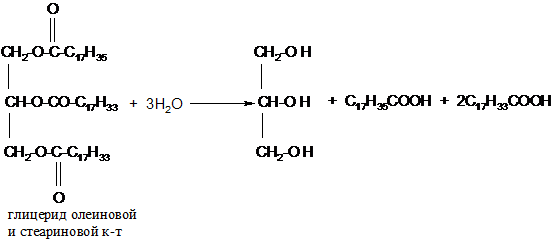
б) щелочной гидролиз жиров (омыление)

2. Гидрогенизация жиров – процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жиров. При этом остатки непредельных кислот переходят в остатки предельных кислот, и жидкие жиры превращаются в твёрдые (эту реакцию проводят на маргариновых заводах)

3. Жидкие жиры, взаимодействуя с кислородом воздуха, способны образовывать твёрдые плёнки – сшитые полимеры

4. При длительном хранении под действием влаги, кислорода воздуха, света и тепла жиры приобретают неприятный запах и вкус. Этот процесс называется ²прогорканием². Неприятный запах и вкус обусловлены появлением в жирах продуктов их превращения – свободных жирных кислот, гидроксикислот, альдегидов и кетонов.
Мыла
Мылами называются соли высокомолекулярных органических кислот. Обыкновенные мыла состоят, в основном, из смеси натриевых солей пальмитиновой (C15H31COOH), стеариновой (C17H35COOH) и олеиновой (C17H33COOH). Калийное мыло имеет вид мази и носит название жидкого мыла. Обычное мыло получают с помощью реакции “омыления” жиров.
В жёсткой воде (содержащей ионы кальция и магния) моющая способность мыла уменьшается. Взаимодействуя с ионами кальция и магния, мыла образуют нерастворимые кальциевые и (или) магниевые соли
2C17H35COO- + 2Na+ + Ca2+ + 2HCO3- → (C17H35COO)2Ca +2Na+ + 2HCO3-
В результате этого мыло образует вместо пены плёнку на поверхности воды и расходуется бесполезно.
ГЛАВА 15. АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Из органических соединений содержащих азот, рассмотрим нитросоединия, амины, нитрилы и изонитрилы.
НИТРОСОЕДИНЕНИЯ
Предельные нитросоединения имеют общую формулу 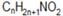 или
или  .
.
Изомерия. Номенклатура
Изомерия нитросоединений начинается, как и в случае монозамещенных углеводородов (спиртов, галогеналкилов и др.) с производных пропана.
Различают первичные – R – CH2 – NO2, вторичные – R2 – CH – NO2 и третичные – R3 – C – NO2 нитросоединения. Нитросоединения называются по углеводороду с приставкой нитро-:
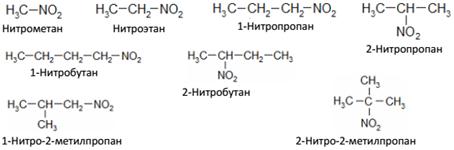
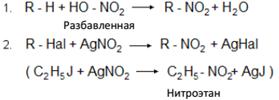
Способы получения
По реакции Коновалова, нитрованием в газовой фазе:
Физические свойства
Нитросоединения жирного ряда – жидкости, обладающие приятным запахом, перегоняющиеся без разложения; малорастворимы в воде, ядовиты, не корродируют металлы, их водные растворы имеют нейтральную реакцию. Плотности соединений с числом атомов углерода менее четырех – больше 1, с числом атомов четыре и более – меньше 1.
Химические свойства
1. При восстановлении нитросоединений образуются первичные амины:
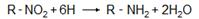
2. Первичные и вторичные нитросоединения растворимы в щелочах с образованием солей. Это объясняется тем, что водородные атомы при углероде, связанном непосредственно с нитрогруппой под влиянием последней, активируются, и в щелочной среде нитросоединения перегруппировываются в аци-нитро-форму (кислотную):
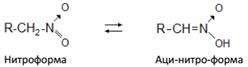
Таким образом, нитросоединения следует рассматривать как таутомерные вещества, реагирующие в нитро- и аци-нитроформах.
Таутомерия (от греч. tautos – тот же и meras – мера) – явление обратимой изомерии, при которой два или более изомера легко переходят друг в друга. Устанавливается равновесие.
Если щелочные растворы нитросоединений обработать минеральной кислотой, то происходит медленный обратный сдвиг равновесия:
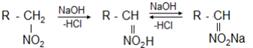
Поэтому нитросоединения относят к псевдокислотам.Для псевдокислот характерно, что сами они нейтральны, не обладают электропроводностью, тем не менее образуют нейтральные соли щелочных металлов.
«Нейтрализация» нитросоединений основаниями (образование нейтральных солей) происходит медленно, а истинных кислот – мгновенно.
3. Активность водородных атомов у углерода, непосредственно связанного с нитрогруппой, проявляется и в ряде других реакций.
Первичные и вторичные нитросоединения реагируют с азотистой кислотой, а третичные – не реагируют:
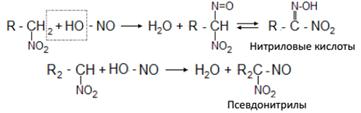
Щелочные соли нитриловых кислот в растворе имеют красный цвет. Псевдонитрилы в растворах и в расплавах окрашены в синий цвет.
4. Первичные и вторичные нитросоединения конденсируются в присутствии щелочей с альдегидами, образуя нитроспирты:
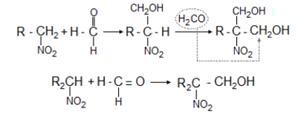
5. Аци-формы первичных и вторичных нитросоединений в водных растворах при действии минеральных кислот образуют альдегиды или кетоны:
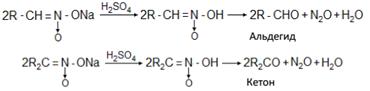
6. Первичные нитросоединения при нагревании с 85%-ной серной кислотой переходят в карбоновые кислоты с отщеплением гидроксиламина. Реакция может служить промышленным методом получения гидроксиламина:

Отдельные представители
В промышленном масштабе производятся первые представители гомологического ряда с числом углеродных атомов С1 – С8. Эти нитросоединения применяются как растворители, для получения нитроспиртов, нитроолефинов. Промышленное значение имеет производство гидроксиламина из нитроэтана при действии H2SO4:
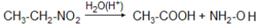
Одновременно получается уксусная кислота.
Все нитросоединения – сильные яды для ЦНС. Некоторые из них обладают раздражающим действием. Таков, например, трихлорнитрометан CCl3NO2 – хлорпикрин. В первой мировой войне использовался как боевое отравляющее вещество (ОВ).
