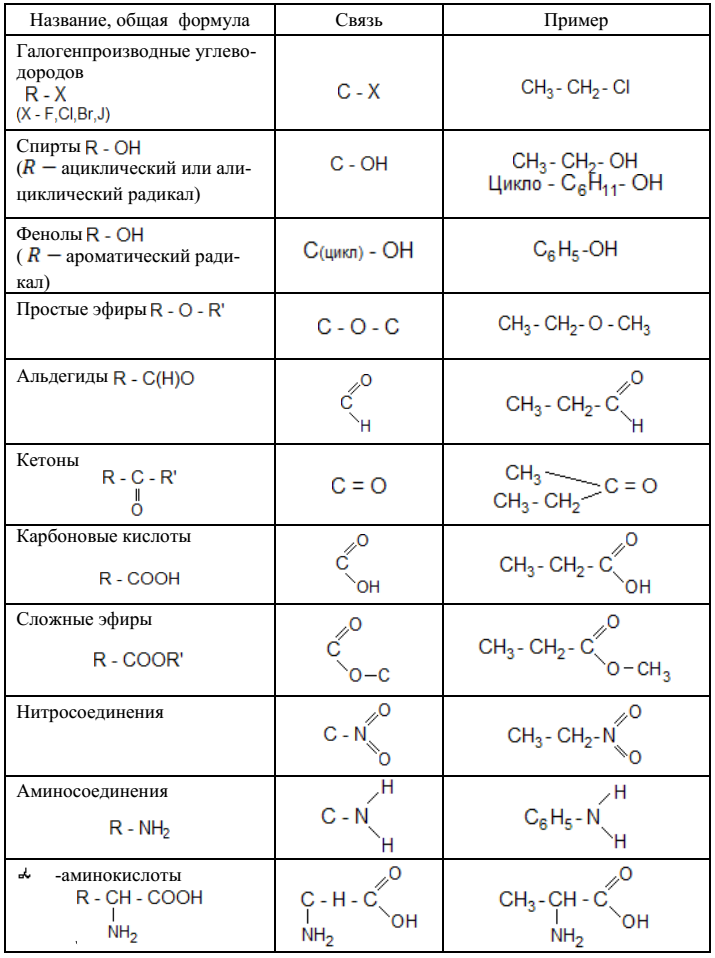
Важнейшие классы органических соединений
Важнейшие классы органических соединений
Общая характеристика органических реакций
Реакции органических соединений подчиняются в принципе тем же законам, что и реакции неорганических соединений, хотя и имеют некоторые специфические особенности.
В неорганических реакциях обычно участвуют ионы; реакции протекают очень быстро, иногда мгновенно и при нормальной температуре. В реакциях органических соединений обычно участвуют молекулы, при этом разрываются одни ковалентные связи и образуются новые. Эти реакции протекают медленнее ионных, часто десятки часов, а для их успешного осуществления во многих случаях необходимо применять повышенную температуру, повышенное давление и катализаторы.
Органические реакции, в отличие от неорганических, редко приводят к высокому выходу продукта. Обычно протекает не одна, а несколько реакций, некоторые из которых при данных условиях преобладают. Поэтому выходы в таких реакциях редко достигают
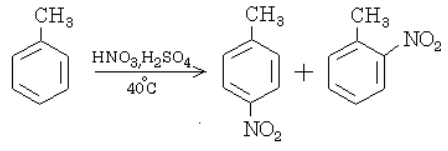
100 %, и химик-органик обычно удовлетворѐн, если получает 70–80%-й выход нужного соединения. В большом числе реакций выходы составляют менее 50 %. Указанные обстоятельства определяют и способ записи органических реакций. Употребляются не химические уравнения, а схемы реакций, в которых обычно не приведены стехиометрические соотношения, но подробно описан способ проведения реакции. Схема показывает, что нитрование толуола проводится смесью азотной и серной кислот при температуре 40 ºС и что при этом образуются как орто-, так и пара-производные. Исходные соединения называют реагентами, а получающиеся соединения (изомеры) – продуктами реакции.
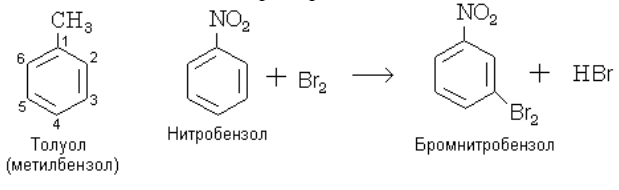
В незамещѐнном бензоле С6Н6 способность всех шести атомов водорода замещаться другими атомами или группами атомов одинакова. Заместитель может находиться у любого из шести атомов углерода. Однако если в бензольном кольце уже имеется какой-нибудь заместитель, то положение, которое займет новый заместитель, зависит от природы первого. Рассмотрим это на примерах.
Пусть мы имеем толуол (метилбензол) и будем подвергать его нитрованию. Введенная в бензольное кольцо нитрогруппа будет находиться только либо в положении 2 (тоже 6), либо в положении 4: рядом (орто-положение) и через два атома углерода от первого заместителя (СН3)-(пара-положение).
Такие заместители, которые ориентируют другие в орто- и пара-положения, называются заместителями первого рода. К ним относятся: – NH2; – OH; – CH3, а также галогены (F, Cl, Br, J).
Заместители второго рода – NO2; – COOH; – CHO; – C ≡ N; – SO3H ориентируют другие заместители в положение через один, т. е. мета-положение. Например:
Присоединения
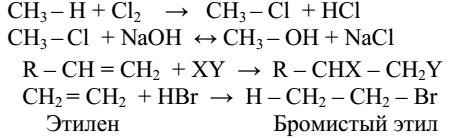
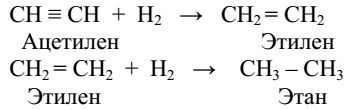
Замещения
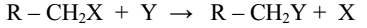
3) отщепления (элиминирования)
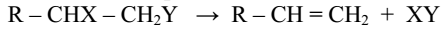
Перегруппировка
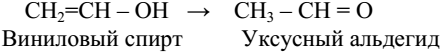
Кроме приведенных четырех типов механизмов реакций на практике употребляют также другие обозначения некоторых классов реакций.
Окисление – реакция при которой под действием окисляющего реагента вещество соединяется с кислородом (либо другим электроотрицательным элементом, например галогеном) или теряет водород (в виде воды или молекулярного водорода):
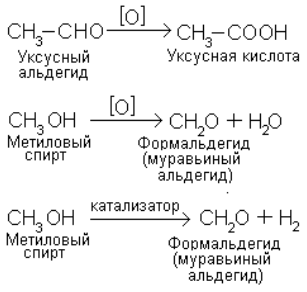
Отщепление водорода в последнем примере называется дегидрированием и проводится с помощью катализатора.
Восстановление – реакция, обратная окислению. Под действием восстанавливающего реагента соединение принимает атомы водорода или теряет атомы кислорода:
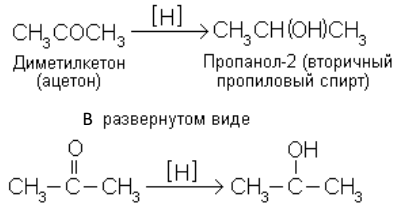
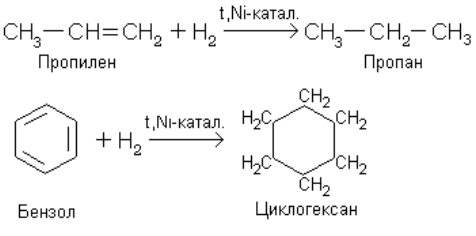
Гидрирование – реакция, представляющая собой частный случай восстановления. Водород присоединяется к кратной связи или ароматическому ядру в присутствии катализатора.
РАЗДЕЛ II. УГЛЕВОДОРОДЫ
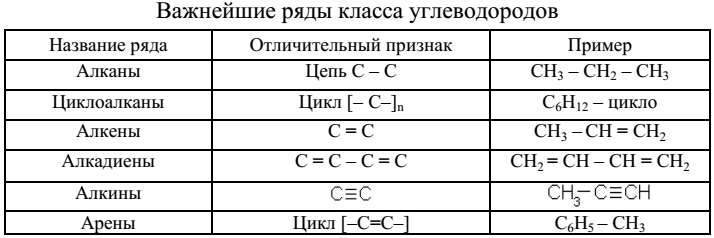
Углеводородами называют самые простые органические соединения, состоящие из углерода и водорода (табл. 2). В зависимости от характера связей и соотношения между количествами углерода и водорода они разделяются на: предельные и непредельные (этиленовые, ацетиленовые и т. д.).
Изомерия. Номенклатура
Углеводороды с n = 1, 2 и 3 могут существовать только в виде одного изомера:
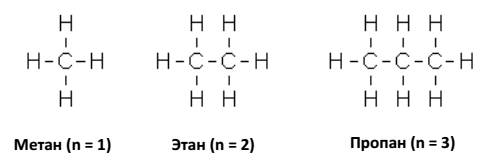
Начиная с четвертого члена гомологического ряда, мы встречаемся с явлением структурной изомерии. Углеводород с n = 4 (бутан) существует в виде двух, углеводород с n = 5 (пентан) в виде трех, углеводород с n = 6 (гексан) в виде пяти структурных изомеров.
Далее количество изомеров быстро возрастает n = 10–75, n = 20 – 336319; n = 30–4111846763.
Такое большое количество и многообразие структурных изомеров требует четкости в их наименовании – номенклатуре.
В органической химии используются эмпирическая (тривиальная) и рациональная номенклатуры.
Эмпирическая номенклатура – это случайные названия органических соединений, обычно указывающие или на их природный источник, или на какое-либо свойство, обратившее на себя в первую очередь внимание химика, впервые получившего это соединение. В настоящее время так называются только наиболее часто используемые соединения, например ацетон, уксусная кислота и т. д.
Рациональная номенклатура учитывает строение называемого соединения. В органической химии долгое время применялась номенклатура, основным принципом которой было обозначение всех изомеров и гомологов как производных родоначальника ряда, в случае предельных углеводородов – метана. В настоящее время эта номенклатура под названием рациональной применяется только в тех случаях, если она дает начальное представление о соединении.
Основные принципы современной систематической номенклатуры были приняты в 1892 г. на съезде химиков в Женеве. Поэтому ее иногда называют женевской. На последующих съездах химиков в эту номенклатуру были внесены изменения и дополнения. Последние изменения были приняты на съездах химиков в 1957 и 1965 гг. в Париже (номенклатура ЮПАК) (Всемирный союз чистой и прикладной химии (International Union of Pure and Applied Chemistry – JUPAC).
Первые четыре предельные углеводорода с нормальной (без разветвлений, когда каждый углерод связан не более чем с двумя углеродами) цепью имеют эмпирические названия:
метан – СН4; этан – С2Н6; пропан – С3Н8; бутан – С4Н10.
Далее названия углеводородов образуются из греческих и латинских (НОНАН) числительных добавлением окончания -ан-:
пентан – С5Н12, гексан – С6Н14, гептан – С7Н16, октан – С8Н18, нонан – С9Н20, декан – С10Н22, ундекан – С11Н24, додекан – С12Н26 и т. д.
Чтобы дать названия изомерам с разветвленной цепью, необходимо знать наименование простейших одновалентных органических радикалов, т. е. остатков образующихся в результате отрыва атомов водорода от предельных углеводородов. Одновалентные радикалы называют, заменяя окончания ан представленных углеводородов на ил: алканы – алкилы, метан – метил (СН3–), этан – этил (СН3–СН2–), пропан-пропил (СН3–СН2–СН2–) бутан-бутил (СН3–СН2–СН2–СН2–), пентан-пентил (амил) и т. д.
Для других простейших остатков применяются следующие названия:
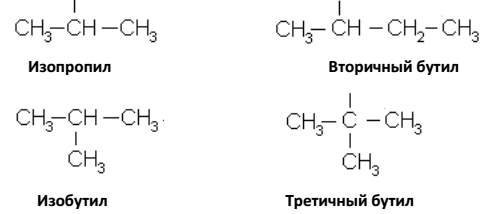
Таким образом от пропана может быть произведено два радикала (пропил и изопропил), от бутана – четыре радикала.
Радикалы с разветвленной структурой можно называть как замещенные радикалы с нормальной структурой, например:
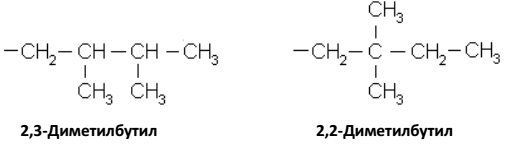
Если свободная валентность в радикале принадлежит атому, имеющему только одну непосредственную связь c углеродными атомами, то радикал называется первичным, при наличии двух таких связей радикал называется вторичным, трех – третичным.
Понятия первичный, вторичный, третичный и четвертичный часто в органической химии относятся к углеродным атомам. Так, например, 2-метилпентан имеет три первичных, два вторичных и один третичный углеродных атомов.
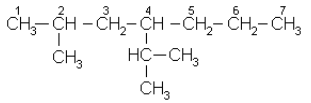
Названия изомеров с разветвленной цепью строятся следующим образом. За основание принимается название углеводорода, которому отвечает в рассматриваемом соединении самая длинная цепь. Далее вся эта цепь нумеруется, начиная с того конца, к которому ближе радикал-заменитель. В названии вещества цифрой показывают место радикала и называют этот заменитель, а затем называют углеводород, которому отвечает главная цепь. Ниже приводятся названия некоторых углеводородов по систематической и эмпирической номенклатурам.
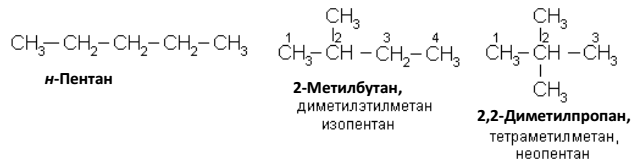
Бутаны
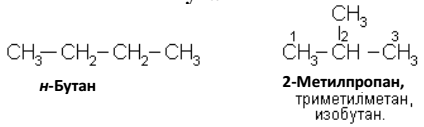
Пентаны
Радикалы перечисляются в порядке возрастания сложности (метил, этил, пропил и т. д.)
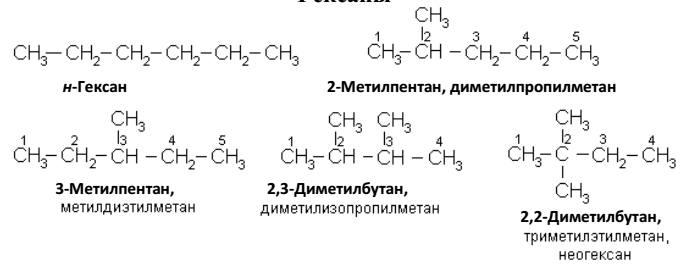
Гексаны
Углеводород может быть назван 2-метил,4-изопропилгептан или 2-метил-4(1-метилэтил)-гептан (систематическая номенклатура) или пропил-изопропил- изобутанметан:
§ 8. Способы получения
Предельные углеводороды могут быть получены из соединений с тем же, меньшим и большим числом углеродных атомов.
1. Предельные углеводороды с небольшим числом углеродных атомов (до 11 включительно) можно выделить фракционной перегонкой природного газа или бензиновой фракции нефти или смеси углеводородов, полученных гидрированием угля (давление
водорода до 250 атм., t = 400–600 ºС) в присутствии катализаторов оксидов железа. Получается жидкая смесь углеводородов, используются низкосортные бурые угли (в Германии из 5 т угля получают 1 т качественного бензина).
2. Предельные углеводороды, начинаются от пентана, получают каталитическим гидрированием этиленовых или более непредельных углеводородов с тем же числом углеродных атомов и таким же строением цепи:
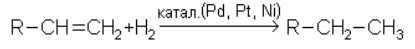
3. Восстановлением галогенопроизводных:
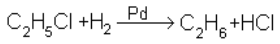
4. Реакция Вюрца (из соединений с меньшим числом углеродных атомов):
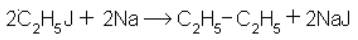
При действии на галогенопроизводные металлического натрия легко образуются натрийалкины, которые далее реагируют с галогеноалкилами (реакция Шорыгина):
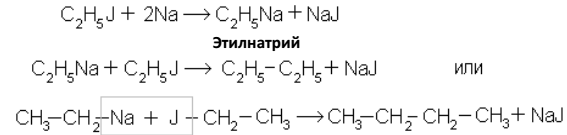
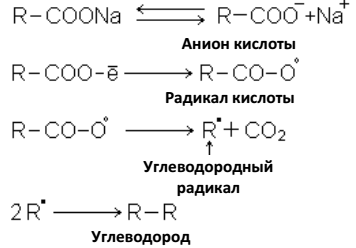
5. Разложением солей карбоновых кислот:
a) электролизом, когда анионы распадаются на аноде с образованием свободных радикалов, которые объединяются в молекулы более сложных предельных углеводородов (реакция Кольбе):
б) нагреванием солей карбоновых кислот с едкими щелочами (натронная известь и натриевые соли кислот) при этом происходит их декарбоксилирование (отщепление CO2) и образуются предельные углеводороды с меньшим числом углеводородных
атомов, чем в исходной кислоте:
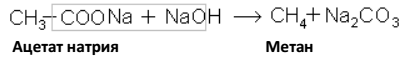
Физические свойства
Физические свойства предельных углеводородов определяются их составом и строением.
Четыре первые члена ряда – газы, далее жидкости, а с C16H34 – твердые вещества.
Температуры кипения в ряду возрастают, причем разность в температурах кипения ближайших гомологов все время уменьшается. Изомеры с нормальной цепью углеродных атомов кипят при более высокой температуре, чем с разветвленной цепью.
Температуры плавления в гомологическом ряду предельных углеводородов медленно возрастают. При этом температуры плавления четных гомологов обычно выше, чем нечетных. Первым твердым углеводородом (tпл. = 104 ºC) является один из изооктанов – гексаметилэтан (2,2,3,3-тетраметилбутан).
Плотности предельных углеводородов в начале быстро, а затем медленно возрастают до величины 0,78.
Растворимость в воде ничтожна.
Атомы в молекулах предельных углеводородов соединены только σ-связями.
Химические свойства
Химические превращения предельных углеводородов могут происходить либо за счет разрыва цепи углеродных атомов, либо за счет отрыва атомов водорода с последующим замещением их другими атомами или группами. Поэтому для предельных углеводородов характерны реакции расщепления или замещения.
Расщепление цепи по σ-связи C–C требует меньшей энергии, т. к. эта связь менее прочная (83,6 Ккал/моль), чем σ-связь C–H (98,8 Ккал/моль), однако химические реакции идут чаще с расщеплением связи C–H, так как эти связи доступны действию
реагентов.
Процессы расщепления связей C–C с образованием свободных радикалов требуют большой энергии активации и поэтому при обычной температуре идут только в присутствии катализаторов.
Реакции замещения могут протекать по ионному или радикальному механизму. Эти реакции условно обозначаются S (замещение по латыни – Substitutio). Реакции нуклеофильного замещения условно обозначаются SN, электрофильного – SE, радикальные
– SR. Эти реакции схематически можно написать так (точки – символическое изображение электронов):
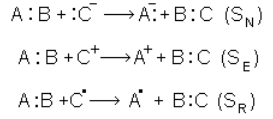
Рассмотрим примеры таких реакций.
1. Галогенирование
Галогенирование – замещение водородных атомов на галогены является одной из наиболее характерных реакций предельных углеводородов. Предельные углеводороды вступают в реакцию со всеми галогенами. Со свободным фтором реакция идет со взрывом, возможны взрывы и в реакции с хлором. Хлор реагирует с предельными
углеводородами под действием света, нагревания или в присутствии катализаторов, причем последовательно замещаются на хлор все атомы водорода:
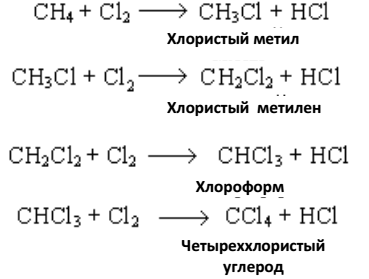
Катализаторами для реакции хлорирования являются многие вещества: сера, йод; хлориды меди, сурьмы, олова, алюминия.
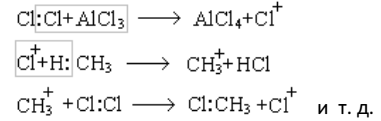
Механизм реакции хлорирования под действием света (фотохимическое хлорирование) является цепным радикальным механизмом SR и установлен Н. Н. Семеновым.
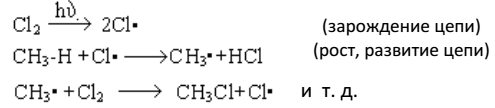
Процесс хлорирования в присутствии катализаторов, например, хлоридов некоторых металлов, имеет цепной ионный механизм SE:
2. Сульфохлорирование и сульфоокисление
Парафины трудно реагируют с концентрированной серной кислотой. При обычной температуре серная кислота на них не действует. При нагревании действует как окислитель. Дымящая серная кислота с высшими парафинами дает сульфокислоты:
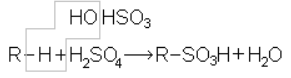
Большое практическое значение имеет другой способ превращения парафинов в сульфокислоты и их производные – реакции сульфохлорирования и сульфоокисления, протекающие по следующим общим уравнениям.
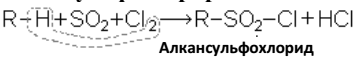
Сульфохлорирование:
Сульфоокисление:
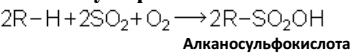
Реакция сульфохлорирования алканов имеет цепной радикальный механизм SR. Носителями цепи, как и в других реакциях предельных углеводородов, являются свободные углеводородные радикалы. Наиболее вероятна следующая схема фотохимического
сульфохлорирования:
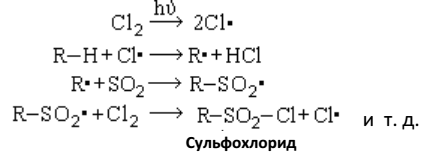
Реакция сульфохлорирования алканов впервые была использована в Германии в 1939–1940 гг. для получения заменителей мыла. Продукты реакции сульфохлорирования дизельной фракции моторного топлива, полученного гидрированием угля, содержащие непрореагировавшие углеводороды и продукты хлорирования, были названы «мерзолами». «Мерзолы» действием щелочей перерабатывались в соли сульфокислот («мерзоляты»), которые смешивались с содой или силикатами и применялись как стиральные порошки.
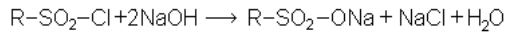
Сульфохлориды могут быть также использованы в кожевенной и текстильной промышленности. Получаемые из сульфохлоридов, действием аммиака, сульфоамиды
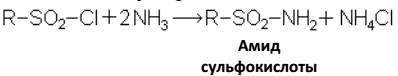
используются в промышленности как эмульгаторы, для изготовления отбеливающих средств, как поверхностно-активные вещества при обработке металлов.
3. Нитрование
Атомы водорода в углеводородах могут быть замещены на нитрогруппу. Эта реакция носит название реакции нитрования и идет по схеме:
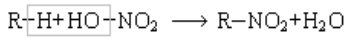
Нитруются парафины только разбавленной азотной кислотой при нагревании (М. И. Коновалов 1888 г.). Азотная кислота как нитрующий агент может быть заменена окислами азота (П. П. Шорыгин).
Реакция нитрования парафинов – радикальный процесс. Начальной стадией нитрования является взаимодействие двуокиси азота (двуокись азота содержится в азотной кислоте и образуется в результате окисления углеводородов азотной кислотой, по строению она является свободным радикалом) с углеводородом, приводящее к возникновению свободных радикалов. Последние с двуокисью азота дают нитросоединения или эфиры азотистой кислоты:
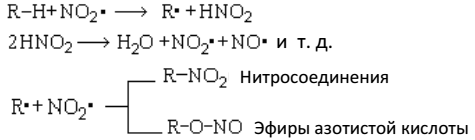
4. Окисление
Парафины при обычных условиях устойчивы к действию не только кислорода воздуха, но и к действию обычных окислителей (KMnO4, K2CrO4, K2Cr2O7 и др.). При поджигании на воздухе парафины воспламеняются и горят, превращаясь в двуокись углерода и воду:
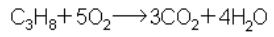
Окисление парафинов протекает по цепному механизму. Парафины – ценное, высококалорийное топливо; в них много водорода, а теплотворная способность водорода больше, чем углерода.
Наиболее важный результат горения метана – выделяющееся при
реакции тепло:
СН4 + 2О2 → СО2 + 2Н2О + 891 кДж/моль.
При сгорании 1 кг метана выделяется 57.000 кДж. Горение – одна из главных реакций парафинов, используемых на практике: природный газ, нефть – важнейшие источники тепла и энергии.
Окисление парафинов кислородом воздуха в более мягких условиях приводит к получению кислородосодержащих органических веществ-спиртов, альдегидов, кетонов, кислот. Например, при окислении бутана получают в промышленности уксусную
кислоту (t = 200 ºС, Р = 50 кгс/см2).
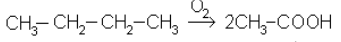
Важное промышленное значение приобрело окисление высших парафинов с целью получения высших жирных кислот, преимущественно для мыловаренной промышленности. Окисления проводят при температуре порядка 150ºС в присутствии катализаторов, например соединений марганца. При этом получают смесь кислот с различной длиной цепи, оксикислоты, кетокислоты, сложные эфиры, спирты, кетоны и т. д.
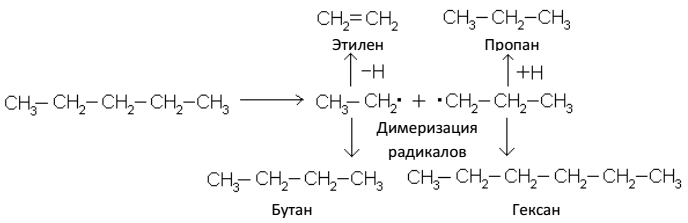
5. Крекинг
Нагревание до 400–600 ºС сообщает молекулам парафинов достаточно энергии для того, чтобы произошел гомолитический разрыв углерод-углеродных связей. Этот процесс носит название крекинг (от англ. Crack – расщепление).
При крекинге предельных углеводородов образуются более простые насыщенные и ненасыщенные углеводороды, например:
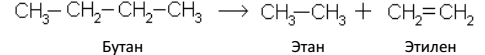
Эта реакция имеет большое практическое значение. При помощи крекинга высококипящие фракции нефти (мазут) превращают в ценные низкокипящие жидкие продукты – бензин, керосин, а также простейшие газообразные углеводороды – сырье для органического синтеза.
Сущность крекинга – гомолитический разрыв углерод-углеродных связей под действием высокой температуры или при содействии катализаторов. Образующиеся при этом радикалы стабилизируются разными путями:
На результаты крекинга, т. е. на соотношение жидких и газообразных продуктов, долю предельных и непредельных углеводородов, оказывают влияние условия крекинга. При более высоких температурах (650–700 ºС) идет более глубокий распад – пиролиз,
при котором образуется много водорода, кокса, простейших предельных и непредельных углеводородов. Наряду с собственно крекингом, т. е. с разрывом сложных молекул на более простые, при термокаталитической обработке предельных углеводородов и их смесей (т. е. нефтяных фракций) идут и другие процессы, главные из которых:
дегидрирование – отнятие водорода с превращением предельных углеводородов в непредельные;
ароматизация алканов и циклоалканов с превращением в ароматические углеводороды;
изомеризация – перестройка углеводородного скелета, например превращение пентана в изопентан:
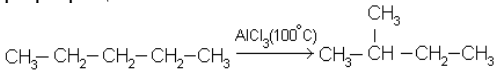
Под действием еще более высоких температур (1000 ºС и выше) молекулы алканов распадаются на элементы.
Отдельные представители
Метан – СН4 – известен под различными названиями, указывающими на его нахождение в природе. Название болотный газ связано с образованием метана при гниении растительных веществ на дне болот. Скопление метана нередко можно встретить в залежах каменного угля, откуда и происходит его название – рудничный газ. Накапливаясь в шахтах, он может служить причиной опасных взрывов.
Атмосфера больших планет (Сатурн, Юпитер) содержит много метана: это указывает на то, что метан может возникать в естественных условиях в отсутствие органической жизни.
Одна из теорий возникновения жизни предполагает, что жизнь
возникла тогда, когда Земля была окружена атмосферой, содержащей CH4,NH3,H2O и Н2. Энергия Солнца и электрические разряды молний способствовали распаду этих молекул до свободных радикалов, которые превратились в сложные органические соединения, включая аминокислоты.
В недрах Земли содержатся большие запасы горючих газов. Они находятся в свободном состоянии в виде природного газа или в растворенном виде в нефти и в надземных водах – попутные нефтяные газы. Природный газ содержит до 98 % метана, а в качестве примесей - этан, пропан и др. Попутный нефтяной газ более беден метаном (30–80 %), но содержит значительные количества его гомологов: этана 4–20 %, пропана 5–22 %, бутанов 5–20 %, а также пентаны и др. Высшие алканы входят в состав нефтей.
Добываемый газ используется как топливо для бытовых и промышленных целей, а также как химическое сырье.
Средняя теплотворная способность 1м3 природного газа превышает 46000 кДж; энергии содержащейся в 1м3 газа достаточно, чтобы выплавить 30 кг чугуна. Замена газом других видов топлива, в частности угля, дает большую экономию, поскольку добыча угля дороже, чем газа, и теплотворная способность его ниже. С использованием природного газа производится около 86 % мартеновской стали, около 42 % проката. Использование природного газа в промышленности вместо кокса и другого топлива снижает себестоимость продукции.
Природный газ как химическое сырье используется в следующих производствах.
1. Получение сажи и водорода путем пиролиза метана:
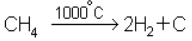
Сажа используется как добавка к каучуку в производстве резины, для приготовления типографской краски и др., водород – для различных синтезов: например, на основе природного газа получают около 75 % NH3.
2. Получение ацетилена.
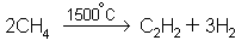
3. Конверсия метана водяным паром в смесь окиси углерода и водорода:
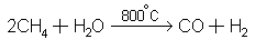
Образовавшаяся смесь служит сырьем для получения синтетического бензина, метилового спирта.
4. Окисление метана воздухом в присутствии катализаторов дает метиловый спирт СН3ОН, формальдегид НСНО, муравьиную кислоту НСООН.
5. Получение синильной кислоты пиролизом смеси метана и аммиака в присутствии кислорода:
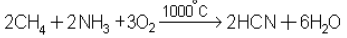
6. Хлорирование метана дает возможность получить хлористый метан CH3Cl, хлороформ CHCl3, четыреххлористый углерод CCl4.
ГЛАВА 3. АЛКЕНЫ
Алкенами называют ненасыщенные углеводороды, содержащие в молекуле одну двойную связь.
Строение и изомерия
Непредельные углеводороды с двойной связью – это углеводороды, в молекулах которых имеется группировка 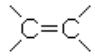 . Они образуют гомологический ряд соединений, общая формула которых CnH2n. Тривиальные названия их получают путем замены окончания "АН" соответствующего углеводорода окончанием "ИЛЕН".
. Они образуют гомологический ряд соединений, общая формула которых CnH2n. Тривиальные названия их получают путем замены окончания "АН" соответствующего углеводорода окончанием "ИЛЕН".
По современным международным правилам названия алкенов строятся подобно названиям алканов, но окончание "АН" заменяется на окончание "ЕН", откуда и происходит общее название алкены.
Родоначальником этого ряда является этилен (этен) С2Н4 – производное от этана С2Н6. В молекуле этилена на два атома водорода меньше, чем у этана. Структурная формула этилена (этена):
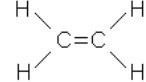 упрощенная
упрощенная 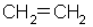 .
.
Гомологический ряд этиленовых углеводородов:
С2H4 – этилен (этен);
С3Н6 – пропилен (пропен);
С4Н8 – бутилен (бутен);
С5Н10 – пентен;
С6Н12 – гексен;
С7Н14 – гептен и т. д.
Каждый последующий член гомологического ряда получается замещением атома водорода на радикал метил – СН3.
Для углеводородов С2 – С4 одинаково употребительны традиционные названия (типа этилен) и систематические названия (типа этен). Радикалы этена и пропена носят специальные названия винил СН2=СН–и аллил СН2=СН–СН2–.
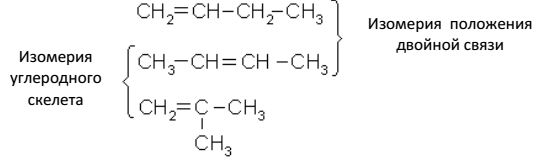
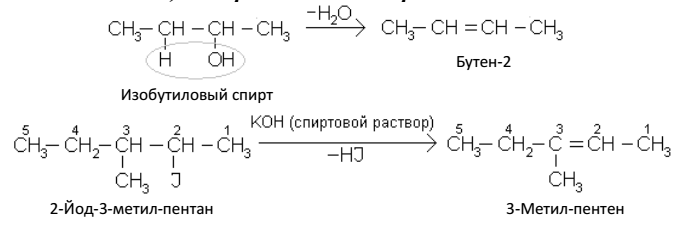
Непредельные углеводороды, как и предельные, имеют изомеры.
Структурные изомеры алкенов могут отличаться разветвлением углеродной цепи (изомерия углеродного скелета) и положением двойной связи (изомерия положения). Первый из этиленовых углеводородов, для которого возможны изомеры, имеет четыре атома
углерода – бутилен (бутен) С4Н8. Для него известны три изомера:
Физические свойства
Первые три члена гомологического ряда этилена – газы, а начиная с пентилов и кончая углеводородами C16H32 – жидкости.
Высшие этиленовые углеводороды – твердые бесцветные вещества. Температура кипения и плавления с длиной цепи гомологов нормального ряда возрастает.
Химические свойства
Двойная связь менее прочна, чем сумма двух одинарных связей. Одна из двойных связей между атомами углерода разрывается, и за счет освобождающихся валентностей к атомам углерода присоединяются другие атомы и группы:
А. Гидрирование
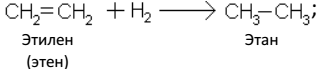
Б. Галогенирование
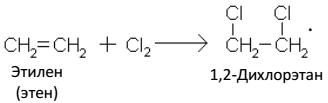
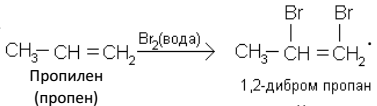
Аналогично протекает взаимодействие алкенов с бромоводородом.
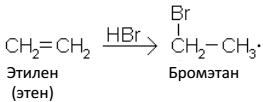
Присоединение галогеноводородов к несимметричным алкенам протекает согласно правилу Марковникова: «Присоединение галогеноводородов к несимметричным алкенам протекает так, что водород присоединяется к тому атому углерода, который содержит большее число атомов водорода, а атом галогена – к атому углерода с меньшим числом водорода»:
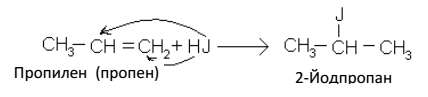
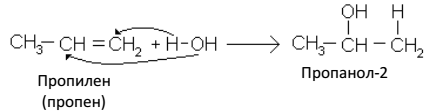
По правилу Марковникова протекают и реакции гидратации, т. е. присоединение воды:
В. Окисление
Алкены обесцвечивают раствор перманганата калия на холоде в нейтральной среде, при этом образуются двухатомные спирты (гликоли):
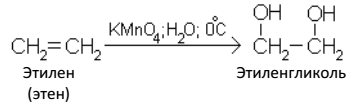
§ 15. Получение алкенов
В природе в значительных количествах не встречаются. Получить их можно следующими способами:
1. Дегидрированием предельных углеводородов (алканов):
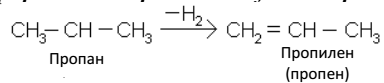
2. Отщеплением галогенов от дигалогенопроизводных предельных углеводородов:
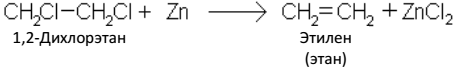
3. Отщеплением галогеноводородов от моногалогенопроизводных предельных углеводородов:
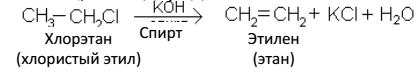
4. Отщеплением воды от спиртов:
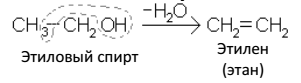
Реакции дегидратации спиртов и дегидрогалогенирования галогенопроизводных предельных углеводородов протекают по правилу Зайцева (1875 г.) "Водород отщепляется от того из соседних атомов, который беднее водородом":
ГЛАВА 4. АЛКИНЫ
Ацетиленовыми углеводородами (алкинами) называют такие соединения углерода с водородом, в молекулах которых имеются атомы, затрачивающие на соединение с соседним атомом углерода три валентности, т. е. образующие тройную связь.
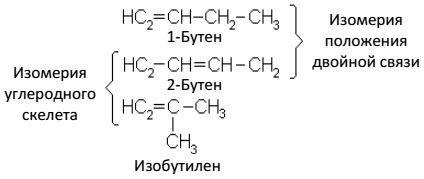
Ацетиленовые углеводороды образуют гомологический ряд с общей формулой СnН2n-2. Родоначальником этого ряда является ацетилен CH ≡ CH.
Изомерия. Номенклатура
Структурная изомерия начинается в ряду ацетиленовых углеводородов с четвертого члена. Однако изомеры C4H6 могут различаться только положением тройной
связи, но не строением углеродного скелета. Последний вид структурной изомерии начинается с пятого члена ряда.
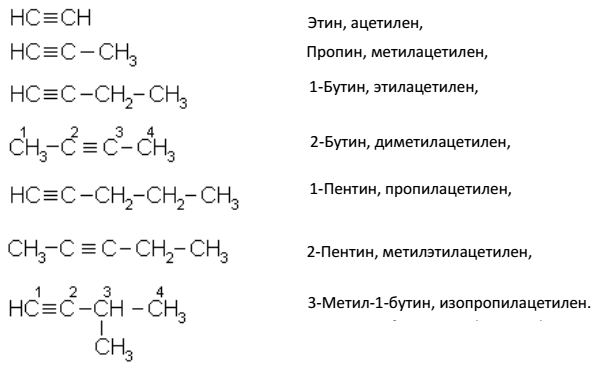
Ацетиленовые углеводороды по систематической номенклатуре называют, пользуясь теми же правилами, что и в случае предельных углеводородов, но окончание АН заменяют окончанием ИН; главную цепь выбирают так, чтобы в нее попала тройная
связь, и нумеруют с того конца, к которому ближе тройная связь. Место тройной связи показывают цифрой. Простейшие ацетиленовые углеводороды часто называют, как алкилзамещенные ацетилена, т. е. по рациональной номенклатуре:
Физические свойства
Углеводороды с С2H2 по C4H6 представляют собой при обычных условиях газы, начиная c углеводорода с пятью атомами углерода в молекуле – жидкости, а с C16H30 – твердые тела.
Положение тройной связи в цепи сильно влияет на температуру кипения. Например: 1-бутин (HC≡ –CH2–CH3) кипит при 8,5 ºC, а 2-бутин (CH3–C≡C–CH3) при 27 ºC, тогда как оба бутана (n-бутан и изобутан) и все бутилены при обычных условиях –
вещества газообразные.
Химические свойства
Углеводороды ряда ацетилена в еще большей степени являются ненасыщенными, чем олефины. Для них характерны следующие реакции.
1. Присоединение водорода (гидрогенизация, гидрирование). При этой реакции, так же как и при ряде других реакций, процесс присоединения идет в две стадии:
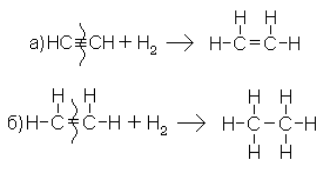
Реакция, как и в случае олефинов, протекает в присутствии катализаторов Pt, Ni.
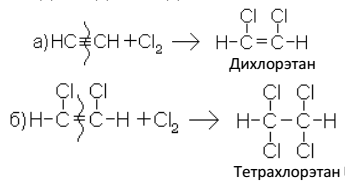
2. Присоединение галогенов (галогенирование, галогенизирование). Процесс идет в две стадии:
3. Присоединение воды (гидратация)
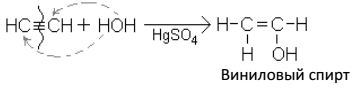
Образующийся виниловый спирт – вещество непрочное: он изомеризуется* в уксусный альдегид:
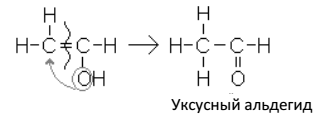
Реакция присоединения воды к ацетилену, протекающая при каталитическом действии солей ртути (гетерогенный катализатор), была открыта русским ученым М. Г. Кучеровым и носит его имя. Реакция имеет большое практическое значение, т. к. уксусный
альдегид применяется в технике для получения уксусной кислоты и этилового спирта.
По этой же реакции из других ацетиленовых углеводородов получаются кетоны:
ГЛАВА 5. АЛКАДИЕНЫ
Номенклатура. Строение
Большое практическое значение находят непредельные углеводороды, содержащие две двойные связи С = С – диеновые углеводороды (алкадиены), особенно сопряженные диены, в которых две двойные связи С = С разделены простой связью С – С:

В молекуле диеновых углеводородов на четыре атома водорода меньше, чем в предельных углеводородах. Общая формула их CnH2n-2. Поскольку для образования двух двойных связей необходимо по крайней мере три атома углерода, в этом ряду соединения
с одним и двумя атомами углерода не существуют.
В зависимости от взаимного расположения двойных связей диеновые углеводороды можно разделить на три основных типа:
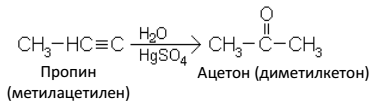
1) углеводороды с кумулированными (примыкающими к одному углероду) двойными связями (аллен и его гомологи):
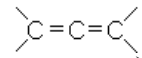
2) углеводороды с сопряженными двойными связями (дивинил
и его гомологи):
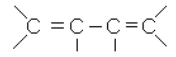
3) углеводороды с изолированными двойными связями:
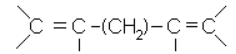
Диеновые углеводороды называются так же как и этиленовые углеводороды, только вместо окончания ЕН ставится окончание ДИЕН (так как двойных связей две). Положение двойных связей показывается цифрами. Для некоторых диенов сохранились эмпирические или старые рациональные названия:

Химические свойства
Диены с кумулированными и изолированными двойными связями обладают свойствами, близкими к свойствам олефинов: легко вступают в те же реакции присоединения.
Сопряженные диены проявляют особые свойства, в частности, образуют продукты 1, 4-присоединения с одной двойной связью посредине:
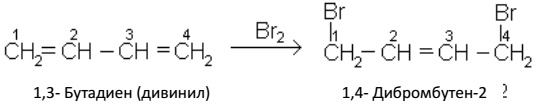
Алкадиены способны вступать в реакции полимеризации:
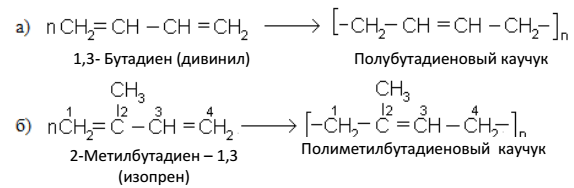
Последний каучук (б) – это полимер, существующий в природе, а полибутадиеновый каучук получен искусственно (С. В. Лебедев, 1932 г.) и называется синтетическим каучуком.
Получение алкадиенов
В промышленности для получения алкадиенов используют метод каталитического дегидрирования алкано
