Электролитическая диссоциация. Степень диссоциации. Сильные и слабые электролиты. Константа диссоциации
Электролитическая диссоциация (ионизация) – это распад вещества на ионы под действием растворителя.
Электролиты– вещества, которые распадаются в воде, в других полярных жидкостях или расплавах на частицы (ионы), способные проводить электрический ток.
Кислоты – электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода:
HNO3 D H+ + NO 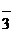 ; H2SO4 D 2H+ + SO
; H2SO4 D 2H+ + SO 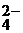 .
.
Основания – электролиты, при диссоциации которых из анионов образуются только гидроксид-анионы. Например, гидроксид натрия диссоциирует с образованием катионов натрия и гидроксид-анионов:NaOH D Na+ + ОН  ; Ca(OH)2 D Ca2+ + 2ОН
; Ca(OH)2 D Ca2+ + 2ОН  .
.
Соли – электролиты, при диссоциации которых образуются катионы металлов и анионы кислотных остатков:
Cu(NO3)2 D Cu2+ + 2NO 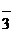 ; KCl D K+ + Cl
; KCl D K+ + Cl  .
.
Для количественной характеристики диссоциации электролита при данных условиях используют степень диссоциации α – отношение числа распавшихся на ионы молекул к общему числу молекул электролита. Степень диссоциации электролита определяется эмпирически и выражается в долях единицы или в процентах. Если α=0, то диссоциация отсутствует, а если α=1, или 100 %, то электролит полностью распадается на ионы. Если же α=0,3, то это означает, что из 100 молекул данного электролита 30 распалось на ионы. Степень диссоциации зависит от природы растворителя и растворенного вещества, от температуры, от концентрации.
По степени диссоциации электролиты делятся на сильные и слабые.
Вещества, молекулы которых хорошо распадаются на ионы, называются сильными электролитами.
К ним относятся некоторые кислоты: HCl, HBr, НI, H2SO4, HNO3, HClO4; основания металлов I-А группы и щелочноземельных металлов: NaOH, KOH, LiOH, CsOH, Са(OH)2, Sr(OH)2, Ва(OH)2; все соли: CuSO4, Li2CO3, K2S, FrCl, CsNO3, MnCO3, MnS, AgBr, PbCO3, FeF2, CuS, BaCO3 и др.
Слабые электролиты – вещества, молекулы которых неполностью распадаются на ионы, т.е. в растворе могут присутствовать как ионы, так и нераспавшиеся молекулы. К ним относится вода Н2О, ряд кислот: HF, H2S, H2CO3, H3PO4, H2SO3, H2SiO3, CH3COOH, HCN, HSCN; основание NH4OH и практически все гидроксиды p- и d-металлов, например: Cu(OH)2, Al(OH)3, Fe(OH)2, Fe(OH)3, Pb(OH)2, Cr(OH)3 и др.
Слабые многоосновные кислоты диссоциируют ступенчато, последовательно отщепляя один ион Н+ за другим.
Например, диссоциация угольной кислоты будет проходить в две ступени, образуя на первой ступени гидрокарбонат-ион, а на второй – карбонат-ион:
1. Н2СО3 D Н+ + НСO 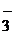 K1
K1
2. НСО 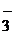 D Н+ + СО
D Н+ + СО 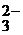 K2
K2
------------------------------------------------------------
Н2СО3 D 2Н+ + СО 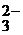 .
.
Слабые основания многозарядных катионов также диссоциируют ступенчато последовательно, отщепляя один ион OН  за другим. Например, гидроксид железа (III) будет диссоциировать в три ступени:
за другим. Например, гидроксид железа (III) будет диссоциировать в три ступени:
1. Fe(ОH)3 D Fe(ОH)2+ + OH  K1
K1
2. Fe(ОH)2+ D Fe(ОH)2+ + OH  K2
K2
3. Fe(ОH)2+ D Fe3+ + OH  K3
K3
Fe(ОH)3 D Fe3+ + 3 OH  .
.
Каждая ступень диссоциации характеризуется своей константой диссоциации.
Константа равновесия электролитической диссоциации слабого электролита называется константой диссоциации или константой ионизации. Константа диссоциации зависит от природы растворенного вещества и растворителя, температуры, не зависит от концентрации. Значения констант диссоциации – табличные данные.
Константа диссоциации характеризует силу электролита.
