Растворы. Способы выражения концентрации растворов
Министерства здравоохранения Российской Федерации
Х И М И Я
Учебное пособие для студентов I курса специальностей
Лечебное дело
Педиатрия
ОМСК – 2013
УДК 54(076)
ББК 24я73
Р 84
Степанова И.П., Ганзина И.В., Уварова Т.А., Мендубаева З.А. Химия: Учебное пособие для студентов I курса специальностей:060101 – лечебное дело;060103 – педиатрия. – Омск: Изд-во ОмГМА, 2013. – 118 с.
Авторы: И.П. Степанова, И.В. Ганзина, Т.А. Уварова, З.А. Мендубаева.
Рецензенты:
Доктор педагогических наук, доцент О.И. Курдуманова – зав. кафедрой химии и методики преподавания химии ФГБОУ ВПО ОмГПУ.
Кандидат химических наук, доцент Н.А. Пономарева – доцент кафедры химии ФГБОУ ВПО ОмГАУ им. П.А. Столыпина.
ISBN
Учебное пособие для подготовки к занятиям дисциплины «Химия» включает содержание разделов дисциплины и перечень контролируемых учебных элементов; тематический план лекций и занятий, составленных в соответствии с новой программой ФГОС – 3; инструкцию по охране труда и технике безопасности для студентов при работе в лабораториях кафедры химии; кодификатор зачетной работы. Пособие содержит методические материалы, включающие цель, план и содержание занятия; типовые обучающие задачи, тестовые задания, вопросы для подготовки к занятиям, контрольные задания к каждой теме. Для подготовки к зачету по дисциплине «Химия» представлена характеристика зачетной работы и инструкция по ее выполнению. Учебное пособие предназначено для студентов 1-ого курса ОмГМА специальностей 060101 – лечебное дело, 060103 – педиатрия.
ÓИ.П. Степанова, И.В. Ганзина, Т.А. Уварова, З.А. Мендубаева, 2013
ÓГБОУ ВПО «ОмГМА Росздрава», 2013
|
Предисловие
Учебное пособие дисциплины «Химия» рекомендован студентам 1-ого курса специальностей 060101 – лечебное дело, 060103 – педиатрия Омской государственной медицинской академии в качестве пособия для самостоятельной подготовки к лабораторным занятиям, контрольным работам и зачету по дисциплине «Химия». Содержание учебного пособия соответствует рабочей программе, составленной на основе федерального государственного образовательного стандарта высшего профессионального образования.
Пособие, также как и рабочая программа, составлено по модульному принципу и является необходимой составной частью учебно-методического комплекса по химии.
Учебное пособие включает следующие разделы (части):
- тему и содержание занятий;
- контрольные вопросы и задания;
- инструкцию по технике безопасности при работе в химической лаборатории;
- характеристику зачетной работы и инструкцию по ее выполнению.
Структура занятий включает тему, теоретическое введение (краткий курс теории), типовые задания с анализом их решения, контрольные вопросы (ориентируют студента в самостоятельной работе с литературой, помогают лучше усваивать материал), ситуационные задачи (носят практикоориентированный характер), список литературы (содержит ссылки на соответствующие источники).
Содержание всех компонентов структуры пособия позволит студентам – первокурсникам закрепить пройденный программный материал и будет способствовать его более глубокому и прочному усвоению, что очень важно для будущего врача, поскольку химия входит в число наук, составляющих фундамент современной медицины.
Медико-биологическая направленность предлагаемых заданий значительно расширит представления студентов – первокурсников о тесной связи химии и медицины, а также роли химии и ее методов в прогнозировании, диагностике и выявлении молекулярных механизмов возникновения различных заболеваний. Это открывает большие возможности для использования более эффективных средств их профилактики и лечения.
Обучение по дисциплине «Химия» складывается из аудиторных занятий (72 часа), включающих лекционный курс и лабораторные занятия, и самостоятельной работы (36 часов). В соответствии с требованиями ФГОС ВПО в учебном процессе широко используются активные и интерактивные формы проведения занятий.
Лекционный материал подается в форме электронных презентаций, проблемных лекций, лекции-визуализации.
Основное учебное время выделяется на лабораторные практикумы по закреплению знаний и получение практических навыков.
Занятия проводятся в виде семинаров, лабораторных работ с использованием наглядных пособий, решением ситуационных задач, тестовых заданий.
Для организации самостоятельной работы студентов используются технологии направляющего текста, проблемного обучения, дидактических задач, обеспечивающие дифференцированный подход к обучаемым и возможность организовывать индивидуальную и групповую работу.
Работа с учебной литературой рассматривается как вид учебной работы по дисциплине и выполняется в пределах часов, отводимых на её изучение.
Каждый обучающийся обеспечен доступом к библиотечным фондам Академии и кафедры.
При подготовке к занятию студенты самостоятельно изучают учебную литературу, оформляют домашние задания и рефераты и представляют доклады на конференцию. Самостоятельная работа способствует формированию активной жизненной позиции поведения, аккуратности, дисциплинированности.
Исходный уровень знаний студентов определяется тестированием, проверкой выполнения домашнего задания, текущий контроль усвоения предмета определяется устным опросом в ходе занятий, ответами на тестовые задания и контрольные вопросы.
Изучение дисциплины завершается сдачей зачета. Для студентов, систематически посещающих лекции и учебные занятия, не имеющих неудовлетворительных оценок – зачет складывается по накопительной системе. Студенты, имеющие пропуски лекций и/или занятий и неудовлетворительную успеваемость, сдают зачет по контрольным заданиям в тестовой и письменной формах.
1. Тематические разделы дисциплины «Химия»
Типовые задачи
Задача 1.Определите молярную концентрацию раствора натрия гидроксида с массовой долей 30%, плотность раствора 1,29 г/см3.
| Дано: | Решение: |
| W(NaOH) = 30 % | 1. Найти массу 1 дм3 раствора: |
| ρр(NaOH) = 1,29 г/см3 | (1 дм3 = 1000 см3) |
| С(NaOH) = ? | mр = Vр · ρ р = 1000 · 1,29 = 1290 (г) |
| 2. Найти массу NaOH в 1 дм3 раствора: W(NaOH) · mр 30 · 1290 m(NaOH) = ----------------------- = --------------- = 387 (г) 100 100 | |
| 3. Определить молярную массу натрий гидроксида: M(NaOH) = 23 + 16 + 1 = 40 г/моль | |
| 4. Определить молярную концентрацию раствора натрий гидроксида: m(NaOH) 387 C(NaOH) = -------------------- = ---------- = 9,68 (моль/дм3) M(NaOH) · Vр 40 · 1 | |
| Ответ: С(NaOH) = 9,68 моль/дм3 |
Задача 2.Какова массовая доля (%) пероксида водорода в растворе, применяемом наружно как кровоостанавливающее и дезинфицирующее средство, если молярная концентрация этого раствора составляет 0,89 моль/дм3, плотность раствора 1 г/см3?
| Дано: | Решение: |
| С(H2О2) = 0,89 моль/дм3 | 1. Найти массу 1 дм3 раствора: |
| ρ р(H2О2) = 1 г/см3 | mр = Vр · ρ р = 1000 · 1 = 1000 (г) |
| --------------------------------- | 2. Определить молярную массу пероксида водорода: |
| W(H2О2) = ? | M(H2О2) = 34 г/моль |
| 3. Найти массу H2О2: m(H2О2) = С(H2О2) · М(H2О2) · Vр = 0,89 · 34 · 1 = 30,26 (г) | |
| 4. Найти массовую долю (%) пероксида водорода в растворе: m(H2О2) 30,26 · 100 W(H2О2) = --------------- · 100 = ------------------ · 100 = 3,03 % mр 1000 | |
| Ответ: W(H2О2) = 3,03 % |
Задача 3.Определите молярную концентрацию эквивалента раствора гептагидрата сульфата магния MgSO4 · 7Н2О, применяемого внутривенно для снижения давления крови, если массовая доля соли в растворе составляет 20 %, плотность раствора 1,22 г/см3.
| Дано: | Решение: |
| W(MgSO4 · 7Н2О) = 20 % | 1. Найти массу 1 дм3 раствора: |
| ρр(MgSO4 · 7Н2О) = 1,22 г/см3 | mр = Vр · ρ р = 1000 · 1,22 = 1220 (г) |
| С(1/z MgSO4 · 7Н2О) = ? | |
| 2. Найти массу соли в 1 дм3 раствора: | |
| W(MgSO4 · 7Н2О) · mр 20 · 1220 m(MgSO4 · 7Н2О) = ------------------------------ = -------------- = 244 (г) 100 100 | |
| 3. Определить молярную массу эквивалента соли: M(½ MgSO4 · 7Н2О) = 246/2 = 123 г/моль | |
| 4. Определить молярную концентрацию эквивалента раствора: m(½ MgSO4 · 7Н2О) 244 C(½ MgSO4 · 7Н2О) = ---------------------------------- = ---------- = 1,98 (моль/дм3) M(½ MgSO4 · 7Н2О) · Vр 123 · 1 | |
| Ответ: С(½ MgSO4 · 7Н2О) = 1,96 моль/дм3 |
Задача 4.Определите титр изотонического раствора натрия хлорида, если в 150 см3 раствора содержится 1,3163 г NaCl.
| Дано: | Решение: |
| Vр(NaСl) = 150 см3 | m(NaCl) 1,3163 t(NaCl) = -------------- = ------------ = 8,775 · 10 – 3 (г/см3) Vр 150 |
| m(NaCl) = 1,3163 г | |
| t(NaCl) = ? | |
| Ответ: t(NaCl) = 8,775 · 10 – 3 г/см3 |
Задача 5.Определите массовую долю (%) раствора кальция хлорида, применяемого перорально, молярная концентрация эквивалента которого составляет 2 моль/дм3, плотность раствора 1,11 г/см3.
| Дано: | Решение: |
| С(½СаСl2) = 2 моль/дм3 | 1. Найти массу 1 дм3 раствора: |
| ρ р(СаСl2) = 1,11 г/см3 | mр = Vр · ρ р = 1000 · 1,11 = 1110 (г) |
| W(СаСl2) = ? | 2. Определить молярную массу эквивалента кальций хлорида: |
| M(½СаСl2) = М(СаСl2) : 2 = 111 : 2 = 55,5 г/моль | |
| 3. Найти массу кальций хлорида в 1 дм3 раствора: m(СаСl2) = С(½СаСl2) · М(½СаСl2) · Vр = 2 · 55,5 · 1 = 111 (г) | |
| 4. Найти массовую долю (%) кальций хлорида в растворе: m(½СаСl2) 111 W(СаСl2) = ---------------- · 100 = --------- · 100 = 10 % mр 1110 | |
| Ответ: W(СаСl2) = 10 % |
Тестовые задания для самоконтроля
Установите соответствие
4. КОНЦЕНТРАЦИОННЫЕ ПОНЯТИЯ И ЕДИНИЦЫ ИЗМЕРЕНИЯ:
| КОНЦЕНТРАЦИОННЫЕ ПОНЯТИЯ | ЕДИНИЦЫ ИЗМЕРЕНИЯ |
| А) Молярная масса вещества | 1) мг, г, кг |
| Б) Молярная концентрация вещества в растворе | 2) безразмерная величина |
| В) Молярная масса эквивалента | 3) г/см3; г/мл |
| Г) Плотность раствора | 4) см3, дм3, м3, мл, л |
| Д) Количество вещества | 5) г/моль |
| Е) Масса вещества | 6) моль·дм-3 |
| Ж) Массовая доля вещества в растворе | 7) % |
| З) Фактор эквивалентности | 8) моль |
5. КОНЦЕНТРАЦИОННАЯ ХАРАКТЕРИСТИКА РАСТВОРА И СООТВЕТСТВУЮЩЕЕ ЕЙ ОПРЕДЕЛЕНИЕ:
| КОНЦЕНТРАЦИОННАЯ ХАРАКТЕРИСТИКА | ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИОННОЙ ХАРАКТЕРИСТИКИ |
| А) Химический эквивалент – это … | 1. число моль вещества в одном кубическом дециметре (литре) раствора. |
| Б) Массовая доля растворённого вещества - это … | 2. выражение 1/z, показывающее какая доля реальной частицы вещества соответствует эквиваленту. |
| В) В о/в реакциях число z это … | 3. число отданных или принятых электронов. |
| Г) Фактор эквивалентности – это … | 4. число моль эквивалента вещества в одном кубическом дециметре (литре) раствора. |
| Д) Молярная концентрация – это … | 5. отношение массы растворённого вещества к объёму раствора. |
| Е) Титр – это … | 6. отношение массы растворённого вещества к массе раствора. |
| Ж) В обменных реакциях число z это … | 7. реальная или условная частица вещества, которая в обменной реакции эквивалентна одному протону, а в о/в реакции – одному электрону. |
| З) Молярная концентрация эквивалента вещества – это … | 8. суммарный заряд обменивающихся ионов. |
Дополните высказывание
6. МОЛЯРНАЯ МАССА ЭКВИВАЛЕНТА ОСНОВАНИЯ ЕСТЬ ОТНОШЕНИЕ МОЛЯРНОЙ МАССЫ ОСНОВАНИЯ К ЧИСЛУ _____________УЧАСТВУЮЩИХ В РЕАКЦИИ.
7.ГОМОГЕННЫЕ (ОДНОФАЗНЫЕ) СИСТЕМЫ ПЕРЕМЕННОГО СОСТАВА, СОСТОЯЩИЕ ИЗ ДВУХ ИЛИ БОЛЕЕ КОМПОНЕНТОВ НАЗЫВАЮТСЯ ______.
Контрольные задания
08. В простокваше, йогурте, кефире содержится 0,6 – 1% молочной кислоты, которая обладает противомикробным действием. Вот почему кисломолочные продукты широко рекомендуются для лечебного питания. Рассчитайте молярную концентрацию молочной кислоты в этих продуктах (плотность раствора примите равной 0,99 г/мл).
09. В медицинской практике используют гормональный препарат адреналин в виде растворов. В ампуле содержится 1 мл 0,1%-ного раствора (ρ = 1 г/мл). Вычислите молярную концентрацию этого раствора и массу адреналина в 1 мл раствора, введенного в организм (Мадр = 219,7 г/моль).
10. Хлорид цинка используется в качестве вяжущего и асептического средства. Определите молярную концентрацию, молярную концентрацию эквивалента, массовую долю и титр раствора, содержащего 5 г ZnCl2 в 100 г раствора (ρ = 1 г/мл).
Литература
1. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для вузов /
Ю. А. Ершов, В.А. Попков, А.С. Берлянд и др.; Под ред. Ю.А. Ершова. – 5-е изд., стер. – М.: Высш.шк., 2005. – С. 42–49.
2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для студентов медицинских спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; Под ред. Ю.А. Ершова, В.А. Попкова. – М. : Высш. шк., 2008. – С.5-17.
Типовые задачи
Задача 1.Рассчитайте объем (см3) раствора серной кислоты с массовой долей 26 % (плотность раствора 1,19 г/см3), необходимого для приготовления 150 см3 раствора серной кислоты с молярной концентрацией 0,2 моль/дм3.
| Дано: | Решение: |
| W(H2SO4) = 26 % | 1. Определить молярную массу серной кислоты: М(H2SO4) = 98 г/моль |
| ρ р(H2SO4) = 1,19 г/см3 | |
| V1(р-ра) = 150 см3 = 0,15 дм3 | 2. Найти массу вещества серной кислоты в 0,15 дм3 раствора с молярной концентрацией 0,2 моль/дм3: |
| С(H2SO4) = 0,2 моль/дм3 | |
| V2(р-ра) = ? | m(H2SO4) = C(H2SO4) · M(H2SO4) · V1 = = 0,2 · 98 · 0,15 = 2,94 (г) |
| 3. Найти массу раствора серной кислоты с W (H2SO4) = 26 % m(H2SO4) 2,94 mр = ---------------- · 100 = --------- · 100 = 11,3 (г) W(H2SO4) 26 | |
| 4. Найти требуемый объем (см3) раствора серной кислоты: mр 11,3 V2 = ------- = --------- = 9,5 (см3) ρр 1,19 | |
| Ответ: V(H2SO4) = 9,5 см3 |
Задача 2. Раствор калия перманганата применяется в медицине как дезинфицирующее средство. Рассчитайте титр раствора KMnO4, содержащего 0,02 моль калия перманганата в 250 см3 раствора.
| Дано: | Решение: |
| n(KMnO4) = 0,02 моль | 1. Определить молярную массу калий перманганата: |
| Vр = 250 см3 | М(KMnO4) = 158 г/моль |
| t(KMnO4) = ? | 2. Найти массу вещества калий перманганата: |
| m(KMnO4) = n(KMnO4) · М(KMnO4) = 0,02 · 158 = 3,16 (г) | |
| 3. Определить титр раствора калий перманганата: m(KMnO4) 3,16 t(KMnO4) = ------------------ = -------- = 0,01264 (г/см3) Vр 250 | |
| Ответ: t(KMnO4) = 0,01264 г/см3 |
Задача 3. Раствор натрия сульфата применяют в медицине перрорально как слабительное средство. Сколько граммов натрий сульфата необходимо для приготовления 200 см3 раствора с молярной концентрацией эквивалента С(½ Na2SO4) = 0,5 моль/дм3?
| Дано: | Решение: |
| С(½ Na2SO4) = 0,5 моль/дм3 | 1. Определить молярную массу эквивалента Na2SO4 |
| V р = 200 см3 = 0,2 дм3 | M (½ Na2SO4) = М(Na2SO4) : 2 = 142 : 2 = 71 г/моль |
| m(Na2SO4) = ? | 2. Найти искомую массу натрия сульфата: |
| m(½ Na2SO4) = C(½ Na2SO4) · M(½ Na2SO4) · Vр = = 0,5 · 71 · 0,2 = 7,1 (г) | |
| Ответ: m(Na2SO4) = 7,1 г |
Задача 4. Определите титр раствора натрия гидроксида, если на тирование 5 см3 его раствора израсходовано 5,4 см3 раствора Н2SO4, с молярной концентрацией эквивалента С(½ Н2SO4) = 0,5 моль/дм3.
| Дано: | Решение: |
| V(NaOH) = 5 cм3 | 1. Определить молярную концентрацию эквивалента раствора натрий гидроксида, используя закон эквивалентов: С(NaOH) · V(NaOH) = C(½ Н2SO4) · V(½ Н2SO4) |
| V(Н2SO4) = 5,4 см3 | |
| С(½ Н2SO4) = 0,5 моль/дм3 | C(½ Н2SO4) · V(½ Н2SO4) 0,5 · 5,4 моль С(NaOH) = ---------------------------------- = ---------- = 0,54 ------ V(NaOH) 5 дм3 |
| t(NaOH) = ? | |
| 2. Определить титр раствора натрий гидроксида: C(NaOH) · M(NaOH) 0,54 · 40 t(NaOH) = -------------------------------- = ------------- = 0,0216 (г/см3) 1000 1000 | |
| Ответ: t(NaOH) = 0,0216 г/см3 |
Тестовые задания для самоконтроля
Литература
1. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для студентов медицинских спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; Под ред. Ю.А. Ершова, В.А. Попкова. – М. : Высш. шк., 2008. – С.65-87.
Типовые задачи
Задача 1.Рассчитать молярную концентрацию эквивалента раствора нитрита натрия, содержащего 13,8 г соли в 200 см3 раствора. Какой объем раствора перманганата калия с молярной концентрацией эквивалента 0,5 моль/дм3 потребуется на титрование 10 см3 исходного раствора нитрита натрия?
| Дано: | Решение: |
| m(NaNO2) = 13,8 г | 1. В процессе реакции осуществляется переход: NaNO2 => NaNO3, т.е. N+3 – 2e => N+5 |
| Vр(NaNO2) = 200 см3 | |
| С(1/5KMnO4) = 0,5 моль/дм3 | М(½ NaNO2) = 69 : 2 = 34,5 г/моль 2. Найти С(½ NaNO2): |
| Vр(NaNO2) = 10 см3 | |
| Vр(KMnO4) = ? С(½ NaNO2 ) = ? | m (NaNO2) 13,8 С(½ NaNO2) = ----------------------- = ------------- = 2 моль/дм3 M(½ NaNO2) · V 34,5 · 0,2 |
| 3. Найти объем раствора перманганата калия: По закону эквивалентов: С(½ NaNO2) · V(NaNO2) = C(1/5KMnO4) · V(KMnO4) | |
| С(½ NaNO2) · V(NaNO2) 2 · 10 V(KMnO4) = ------------------------------------- = ---------- = 40 см3 C(1/5KMnO4) 0,5 | |
| Ответ: С(½ NaNO2) = 2 моль/дм3; V(KMnO4) = 40 см3 |
Задача 2. На титрование раствора пероксида водорода в кислой среде израсходовано 25 см3 раствора перманганата калия с t(KMnO4) = 0, 008 г/см3. Рассчитать массу пероксида водорода, содержащегося в исходном растворе.
| Дано: | Решение: | |
| t(KMnO4) = 0,008 г/см3 | 1. В процессе реакции осуществляется переход: | |
| V(KMnO4) = 25 см3 | H2O2 — 2e → O2 + 2H+ | |
| m(H2O2) = ? | Mn+7 + 5e → Mn+2 | |
| M(½Н2О2) = 34 : 2 = 17 (г/моль) | ||
| М(⅕KMnO4) = 158 : 5 = 31,6 (г/моль) | ||
| 2. Рассчитать массу KMnO4, израсходованного на титрование: m(KMnO4) = t(KMnO4) · V(KMnO4) = 0,008 · 25 = 0,2 (г) 3. По закону эквивалентов: n(½H2O2 ) = n(⅕KMnO4 ), т. е. m(H2O2) m(KMnO4) ---------------- = --------------------- M(½Н2О2) М(⅕KMnO4) m(KMnO4) · M(½Н2О2) 17 · 0,2 откуда m(H2O2) = ----------------------------------- = ------------ = 0,108 (г) М(⅕KMnO4) 31,6 | ||
| Ответ: m(H2O2) = 0,108 г Задача 3. Какую массу щавелевой кислоты Н2С2О4 · 2Н2О необходимо взять для приготовления 200 см3 раствора щавелевой кислоты с молярной концентрацией эквивалента С (½ Н2С2О4 · 2Н2О) = 0,02 моль/дм3? | ||
| Дано: | Решение: | |
| С(½Н2С2О4 · 2Н2О) = 0,02 моль/дм3 | 1. В процессе реакции осуществляется переход: | |
| Vр(Н2С2О4 ) = 200 см3 = 0,2 дм3 | С2О42– - 2е → 2СО2 | |
| m(Н2С2О4 · 2Н2О) = ? | М(½Н2С2О4 · 2Н2О) = 126 : 2 = 63 г/моль | |
| 2. Рассчитать m(Н2С2О4 · 2Н2О): m(Н2С2О4 · 2Н2О) = М(½Н2С2О4 · 2Н2О) · С(½Н2С2О4 · 2Н2О) · Vр m(Н2С2О4 · 2Н2О) = 63 · 0,02 · 0,2 = 1,26 (г) Ответ: m(Н2С2О4 · 2Н2О) = 1,26 г | ||
Тестовые задания для самоконтроля
Дополните высказывание
07. ПРИ ПОМОЩИ РАБОЧЕГО РАСТВОРА БИХРОМАТА КАЛИЯ МЕТОДОМ ОКСИДИМЕТРИИ ОПРЕДЕЛЯЮТ РАЗЛИЧНЫЕ _______________.
08. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ С ПОМОЩЬЮ KMnO4 ЛУЧШЕ ВСЕГО ПРОВОДИТЬ В__________ СРЕДЕ.
Контрольные задания
09. Составить уравнения окислительно-восстановительных реакций взаимодействия перманганата калия в кислой среде со следующими восстановителями:
1) калия нитритом (KNO2)
2) железа (II) сульфатом (FeSO4)
3) калия йодидом (KJ)
4) щавелевой кислотой (Н2С2О4)
5) пероксидом водорода (Н2О2)
10. На примере конкретной реакции охарактеризуйте окислительные свойства перманганата калия в щелочной среде и аргументируйте возможность применения данной среды для перманганатометрических определений.
11. Рассчитайте молярную концентрацию эквивалента раствора пероксида водорода, содержащего 1,5 г Н2О2 в 250 см3 раствора. Какой объём раствора калия перманганата с
С(⅕КMnO4) = 0,2 моль·дм-3 израсходуется на титрование 25 см3 этого раствора?
Литература
1. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для вузов / Ю. А. Ершов, В.А. Попков, А.С. Берлянд и др.; Под ред. Ю.А. Ершова. – 5-е изд., стер. – М.: Высш.шк., 2005. – С. 131 – 138.
2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для студентов медицинских спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; Под ред. Ю.А. Ершова, В.А. Попкова. – М. : Высш. шк., 2008. – С.98-107.
Типовые задачи
Задача 1. Рассчитать калорийность булки хлеба «Бородинский» массой 450 г, если его стограммовый кусочек содержит 7,4 г белков, 57,1 г углеводов и 1,2 г жиров. Коэффициенты калорийности брать по нижней границе.
Решение
1. Найти массы белков (mб), углеводов (mу) и жиров (mж) в 450 г хлеба «Бородинский»:
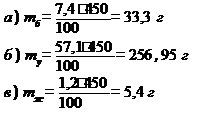 |
2. Рассчитать калорийность булки хлеба «Бородинский» массой 450 г:
К = (mб ·16,5 + mу · 16,5 + mж · 37,7) кДж
К = 33,3 · 16,5 + 256,95 · 16,5 + 5,4 · 37,7 = 4992,705 кДж
Ответ: К = 4992,705 кДж.
Задача 2. Определить изменение энтальпии химической реакции:
2С2Н5ОН(ж) → С2Н5-О-С2Н5(ж) + Н2О(ж) , используя следующие данные:
DН0сгор С2Н5ОН(ж) = –1370,00 кДж·моль-1
DН0сгор С2Н5ОС2Н(ж) = –2720,04 кДж·моль-1
DН0сгор Н2О(ж) = 0 кДж·моль-1
Решение:
Поскольку даны энтальпии сгорания реагентов и продуктов, то используя 2-ое следствие из закона Гесса запишем:
DН0р-я = SDН0сгор. реагентов – SDН0сгор. продуктов
Применительно к этой реакции:
DН0р-я = 2DН0сгорС2Н5ОН(ж) – DН0сгорС2Н5ОС2Н5(ж) = 2 · (–1370,00) – (–2720,04) =
-2740,00 + 2720,04 = –19,96 кДж·моль-1.
Ответ: DН0р-я = –19,96 кДж·моль-1.
Задача 3. Определить стандартную энтальпию образования оксида меди (II) CuO(к), используя следующие данные:
1) 3CuO(к) + 2NH3(г) = 3Cu(к) + N2(г) + 3H2O(ж), DH10 = –299,53 кДж·моль-1
2) 1/2N2(г) + 3/2H2(г) = NH3(г), DH20 = –46,19 кДж·моль-1
3) H2(г) + 1/2О2(г) = H2О(ж), DH30 = –285,838 кДж·моль-1
Решение:
Поскольку необходимо определить стандартную энтальпию образования оксида меди (II), то используя I-ое следствие из закона Гесса запишем:
DН0р-я = SDН0обр. продуктов – SDН0обр. реагентов
Применительно к 1-ой реакции:
DН0р-я = 3DН0обрCu(к) + DН0обрN2(г) + 3DН0обрН2О(ж) – (3DН0обрCuО(к) – 2DН0обрNH3(г)).
Учитывая, что в термохимии энтальпии образования простых веществ азота N2(г) и меди Cu(к) приняты равными нулю и раскрыв скобки, получаем следующее уравнение:
DН0р-я = 3DН0обрН2О(ж) – 3DН0обрCuО(к) – 2DН0обрNH3(г).
Переносим в левую часть уравнения DН0обрCuО(к) с обратным знаком и получаем:
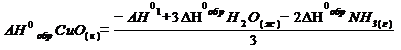 |
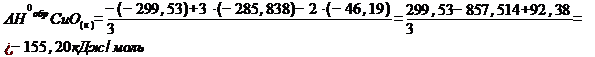 |
Подставим числовые значения указанных параметров:
Ответ: DН0обр CuО(к) = - 155,20 кДж·моль-1.
Задача 4. Рассчитать величину стандартного изобарно-изотермического потенциала для следующей реакции: 2C4H10(г) + 5О2(г) → 4CH3COOH(ж) + 2Н2О(ж), используя следующие данные:
DН0р-я = –2267,94 кДж·моль-1
DS0р-я = –866,30 Дж·моль-1
Решение:
Поскольку даны значения энтальпийного и энтропийного факторов, то для расчета стандартного изобарно-изотермического потенциала используем следующее уравнение:
DG0р-я = DН0 – Т·DS0
Прежде, чем подставить в это уравнение значения указанных параметров, необходимо перевести величину энтропийного фактора в кДж·моль-1. Это будет составлять –0,866 кДж·моль-1.
Подставляем цифровые значения указанных величин в приведенное уравнение. При этом учитываем, что стандартная температура составляет 298 К:
DG0р-я= –2267,94 – 298 · (–0,866) = –2009,782 кДж·моль-1
Ответ: DG0р-я= –2009,782 кДж·моль-1
Тестовые задания для самоконтроля
Дополните высказывание
10. СОГЛАСНО ПЕРВОМУ НАЧАЛУ ТЕРМОДИНАМИКИ “В ЛЮБОЙ ИЗОЛИРОВАННОЙ СИСТЕМЕ ЗАПАС ВНУТРЕННЕЙ ЭНЕРГИИ ___________”.
11. ЛЮБОЙ ОБЪЕК ПРИРОДЫ, СОСТОЯЩИЙ ИЗ ДОСТАТОЧНО БОЛЬШОГО ЧИСЛА СТРУКТРУРНЫХ ЕДИНИЦ, ОТДЕЛЕННЫЙ ОТ ДРУГИХ ОЪЕКТОВ ПРИРОДЫ РЕАЛЬНОЙ, ИЛИ ВООБРАЖАЕМОЙ ГРАНИЦЕЙ, ЯВЛЯЕТСЯ ________________.
12. В ГОМОГЕННОЙ СИСТЕМЕ ОТСУТСТВУЕТ ___________________.
13. ЕДИНИЦЕЙ ЭНЕРГИИ В СИСТЕМЕ СИ ЯВЛЯЕТСЯ ____________.
14. ТЕПЛОВОЙ ЭФФЕКТ ХИМИЧЕСКОЙ РЕАКЦИИ В ИЗОБАРНО-ИЗОТЕРМИЧЕСКИХ УСЛОВИЯХ ЗАВИСИТ ОТ ПРИРОДЫ И СОСТОЯНИЯ РЕАГЕНТОВ И ПРОДУКТОВ РЕАКЦИИ И НЕ ЗАВИСИТ ______________.
Контрольные задания
15. Рассчитайте теплоту биохимической реакции 2Н2О2(ж) = 2Н2О(ж) + О2(г), если
ΔН0обр(Н2О2) = –187,4 кДж/моль, ΔН0обр(Н2О) = –285,8 кДж/моль и при этом образовалось
5,6 дм3 (н.у.) кислорода. Дать анализ полученного результата.
16. Найдите на этикетке данные о калорийности продукта. С помощью таблицы подсчитайте, сколько и как нужно двигаться, чтобы сжечь энергию, полученную вами от порции данного продукта.
Таблица
| Вид деятельности | Расход энергии, ккал/час |
| прогулка пешком плавание бег |
17. Вычислите тепловой эффект реакции:
СН3-СООН + НО-С2Н5 → СН3-СООС2Н5 + Н2О(ж), используя данные
∆Носгор.СН3-СООН = –874,58 кДж/моль
∆Носгор.С2Н5-ОН = –1370,68 кДж/моль
∆Носгор.СН3-СООС2Н5 = –2246,39 кДж/моль
18. Рассчитать калорийность порции жареного картофеля массой 300 г, если 100 г этого блюда содержит 2,8 г белков; 9,5 г жиров; 23,4 г углеводов. Коэффициенты калорийности брать по верхней границе.
Литература
1. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для вузов / Ю. А. Ершов, В.А. Попков, А.С. Берлянд и др.; Под ред. Ю.А. Ершова. – 5-е изд., стер. – М.: Высш.шк., 2005. – С. 10 – 21, 34 – 35.
2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для студентов медицинских спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; Под ред. Ю.А. Ершова, В.А. Попкова. – М. : Высш. шк., 2008. – С. 17-22.
Типовые задачи
Задача 1. Для стандартных условий вычислите изобарно-изотермический потенциал реакции: Аl2О3(т) + 3Н2О(ж) = 2Аl(ОН)3(т)
Справочные данные:
ΔН0обр, кДж/моль ΔS0, Дж/(моль К)
Аl2О3(т) = –1676, 8 50,95
Аl(ОН)3(т) = –1277,0 82,9
Н2О(ж) = –286,02 70,0
Решение: по 1-му следствию закона Гесса рассчитываем ΔН0х.р.:
ΔН0х.р. = 2ΔН0обр(Аl(ОН)3(т)) - ΔН0обр(Аl2О3(т)) - 3ΔН0обр(Н2О(ж)) = –19,14 кДж/моль.
ΔS0х.р. = 2ΔS0(Аl(ОН)3(т)) - ΔS0(Аl2О3(т)) - 3ΔS0(Н2О(ж)) = –95,15 Дж/(моль К) = - 0,09515 кДж/моль.
ΔG0 = ΔН0 – TΔS0 = –19,14 – 298 (–0,09515) = 9,215 кДж/моль.
Ответ: ΔG0 = –1706,93 кДж/моль, т.е. процесс идет самопроизвольно.
Тестовые задания для самоконтроля
Дополните высказывание
08. КРИТЕРИЕМ ВОЗМОЖНОСТИ САМОПРОИЗВОЛЬНОГО ПРОТЕКАНИЯ ПРОЦЕССА СЛУЖИТ ВЕЛИЧИНА ИЗМЕНЕНИЯ ___________________
Контрольные задания
09. Рассчитать изменение стандартной энергии Гиббса для химической реакции:
4HgS(т) + 4CaO(к) = 4Hg(ж) + 3CaS(к) +CaSO4(т) используя следующие данные:
DG0обр HgS(т) = – 48,83 кДж·моль-1
DG0обр CaO(к) = – 604,2 кДж·моль-1
DG0обр Hg(ж) = 0 кДж·моль-1
DG0обр CaS(к) = – 477,4 кДж·моль-1
DG0обр CaSO4(т) = – 1320,31 кДж·моль-1
10. В спортзале Вы сожгли 300 Ккал. Потом Вы съели яблоко, в котором 50 Ккал, а потом еще булочку, энергетическая ценность которой 315 кДж. Каков энергетический запас, накопленный Вашим организмом?
11. Определить коэффициент калорийности для сахарозы С12Н22О11 в ккал·г-1, если стандартная энтальпия сгорания этого углевода равна – 5646,42 кДж·моль-1.
12. Проверьте, нет ли угрозы, что оксид азота (I), применяемый в медицине в качестве наркоза, будет окисляться кислородом воздуха до токсичного оксида азота (II), если ΔG0(N2О(г)) = 104,0 кДж/моль; ΔG0(О2(г)) = 0 кДж/моль; ΔG0(NO(г)) = 87,0 кДж/моль.
Литература
1. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для вузов / Ю. А. Ершов, В.А. Попков, А.С. Берлянд и др.; Под ред. Ю.А. Ершова. – 5-е изд., стер. – М.: Высш.шк., 2005. – С. 21 – 32, 35 – 40.
2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для студентов медицинских спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; Под ред. Ю.А. Ершова, В.А. Попкова. – М. : Высш. шк., 2008. – С.17-31.
Типовые задачи
Задача 1. Вычислить осмотическое давление раствора неэлектролита, в 2 дм3 которого содержится 0,25 моль вещества при 200С.
 Дано: Решение:
Дано: Решение:
n(Х)
Vр-ра = 2 дм3 = 2·10-3 м3 p = C(x)·R·T или π = --------- RT
n = 0,25 моль V
T = 293К p = (0,25 ׃ 2·10-3) · 8,314 · 293 = 3,045·105 Па =
R = 8,314 Дж·моль-1·К-1 = 304,5 кПа

p - ? Ответ:p = 3,045 · 105 Па.
Задача 2. При какой температуре (К) осмотическое давление раствора, содержащего 1,5 г хлорида калия в 1 дм3 раствора, составит 98450 Па?
| Дано: | Решение |
| m(KCl) = 1,5 г | 1. Для растворов электролитов m(X) π · М· V π = i ---------------RT => Т = -------------- M(X) · Vр i · m · R |
| Vр = 1 дм3 = 1·10-3 м3 | |
| π = 98450 Па | |
| Т = |
