Теория химического строения А.М. Бутлерова
Органические соединения отличаются от неорганических свойствами и многообразием. Особенности строения и свойств этих соединений были объяснены в сформулированной Александром Михайловичем Бутлеровым в 1861 году теории химического строения. Согласно этой теории свойства органических соединений определяются их качественным, количественным составом, порядком соединения атомов в молекуле и их взаимным влиянием.
Современная теория строения органических соединений содержит следующие положения:
1. Особенности строения органических соединений связаны с особыми свойствами элемента углерода.
В органических соединениях углерод четырехвалентен, т.е. в образовании связей участвуют все валентные электроны. В возбужденном состоянии атома s- и три p-орбитали валентного уровня содержат по одному электрону:
| С
| С*
|
Выравниваясь по форме и энергии (гибридизуясь), одно s- и три p- валентные орбитали образуют четыре sp3-гибридных облака. Электронная плотность гибридного облака несеметрична, она смещена по одну сторону от ядра. Находясь в состоянии наибольшего расталкивания, эти четыре гибридных облака направлены к вершинам правильного тетраэдра. При перекрывании этих облаков в области повышенной электронной плотности с электронными облаками других атомов образуется четыре прочных σ-связи, направленные под углом 109о28'. Это первое валентное состояние углерода, характерное для предельных углеводородов, например для молекулы метана:
| СH4 | 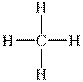 | 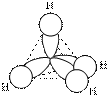 |
Рис.13.1.Строение молекулы метана
2. Многообразие органических соединений объясняется тем, что атомы углерода могут образовываать цепи различной длины, соединяясь между собой прочными ковалентными связями. Однотипные органические соединения, отличающиеся друг от друга на гуппу атомов CH2, образуют гомологические ряды. Например, гомологический ряд метана: метан – СН4, этан – С2Н6, пропан – С3Н8, бутан – С4Н10 и т.д.
Атомы углерода могут вращаться вокруг оси соединяющей их связи. Поскольку угол между связями в углеродной цепи 109о28', то при вращении вокруг оси связи атомы углерода, несвязанные между собой, могут сближаться, молекула при этом может принимать различные формы и даже замыкаться в цикл.
3. Атомы углерода могут соединяться между собой одинарными и кратными связями.
Во втором валентном состояния углерод для образования σ-связей использует три гибридных облака (sp2-гибридизация), расположенные в одной плоскости под утлом 120°. Четвертое, негибридизованное р-облако, расположенное в плоскости перпендикулярной кплоскости гибридных облаков, и боковым перекрыванием с таким же облаком соседнего атома углерода образует π-связь. Наложение π-связи на σ-связь дает кратную двойную связь (рис. 13.2).
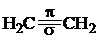 |  | 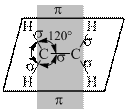 |
Рис.13.2. Строение молекулы этилена
В третьем валентном состоянии для образования σ-связей атомы углерода, используют два гибридных облака (sp-гибридизация). Эти облака вытянуты в линию (угол 180o). Две негибридные р-орбитали, расположенные перпендикулярно друг к другу и к sp-гибридным орбиталям, перекрываясь с негибридными p-орбиталями другого атома углерода, образуют две π-связи, наложением которых на σ-связь формируется тройная связь. Такая связь реализуется в молекуле ацетилена (рис. 13.3).
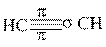 | 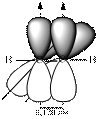 | 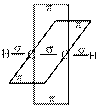 |
Рис.13.3. Строение молекулы ацетилена
Прочность π-связи меньше прочности σ-связи, но с увеличением кратности прочность связи возрастает, что следует из таблицы 4.2.
4. Теория строения объяснила явление изомерии органических соединений.
Углеродные цепи могут быть неразветвленными (нормального строения) и разветвленными (изостроения).
| Н3С–СН2–СН2–СН3 | 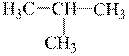 |
| н-бутан (tкип = –0,5°С) | изобутан (tкип = –11,7°С) |
Изомерия может быть связана с положением кратных связей, атомов заместителей и функциональных групп:
| Н3С–СН2–СН=СН2 | Н3С–СН=СН–СН3 |
| Н3С–СН2–СН2–СН2Cl | Н3С–СН2–СНCl–СН3 |
| Н3С–СН2–СН2–СН2OH | Н3С–СН2–СНOH–СН3 |
Известно также несколько видов пространственной изомерии (стереоизомерия). Например, молекулы углеводородов, с двойной связью, вращение вокруг которой невозможно, при наличии у атомов углерода, соединенных такой связью различных заместителей, образуют цис-транс-изомеры.
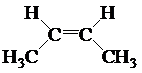 | 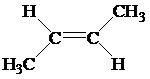 |
| цис-изомер | транс-изомер |
5. Взаимное влияние атомов в молекулах органических веществ обусловлено электронными эффектами.
Индуктивный эффект – смещение электронной пары вдоль σ-связи к более электроотрицательному атому. При этом более электроотрицательный атом приобретает частичный отрицательный заряд (δ–), атом с меньшей электроотрицательностью – частичный положительный (δ+). Смещение электронной плотности показывается стрелкой, например: H3C→Cl, H3C←Na. Смещение электронной плотности передается по цепи атомов углерода, связанных σ-связями, при этом величина дробного заряда быстро убывает по цепи, что объясняется малой подвижностью σ-связей.
Эффект сопряжения (мезомерный эффект) – эффект перераспределения электронной плотности в молекуле, происходящий с участием p-электронов π-связи. Поскольку π-связь расположена над и под линией, соединяющей атомы, то ее электронное облако более подвижно, поэтому смещение электронной плотности связи происходит в большей степени. Величина частичных зарядов на атомах с разной электроотрицательностью, соединенных кратной связью, больше, чем на соединенных σ-связью. Такой вид сдвига электронной плотности связи обозначают изгнутыми стрелками.
Участвовать в перераспределении электронной плотности в молекуле могут и неподеленные пары электронов гетероатомов:
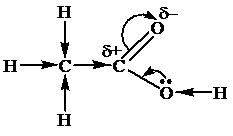
Эффект сопряжения имеет место и в молекулах, в которых двойные связи чередуются с простыми связями, например: CH2=CH–CH=CH2. Негибридные p-орбитали перекрываются не только между 1-2, 3-4 атомами, но и между 2 и 3, образуя для всех четырех атомов углерода общее π-электронное облако (общая электронная орбиталь). Процесс сопряжения ведет к выравниванию энергии и длины связей. Делокализация связей ведет к понижению энергии системы и повышению ее устойчивости.
