Свойства соединений d-металлов
Марганец, проявляя в соединениях степени окисления +2, +3, +4, +6 и +7, образует следующие оксиды, соответствующие им гидроксиды и соли:
| +2 MnO | +3 Mn2O3 | +4 MnO2 | +6 MnO3 | +7 Mn2O7 |
| Mn(OH)2 | Mn(OH)3 | Mn(OH)4 | H2MnO4 | HMnO4 |
 |  |  | ||
| основные | амфотерные | кислотные | ||
| MnSO4 | Mn2(SO4)3 | Mn(NO3)4 Na4MnO4 | K2MnO4 | KMnO4 |
Кислотно-основные свойства этих соединений изменяются с ростом степени окисления от основных через амфотерные к кислотным. Причина такого изменения свойств объясняется изменением сравнительной прочности связей Ме–О и О–Н. С увеличением степени окисления металла и уменьшением его радиуса происходит упрочнение связи Me–О и ослабление связи О–Н.
Окислительно-восстановительные свойства соединений d-металлов также изменяются с повышением степени окисления. Соединения d-металлов в высшей степени окисления проявляют только окислительные свойства:
2KMnO4 + 10KI + 8H2SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O,
окислитель – KMnО4.
Соединения, содержащие d-элемент в промежуточной степени окисления, могут проявлять как окислительные, так и восстановительные свойства:
MnO2 + 2KI + 2H2SO4 = MnSO4 + I2 + K2SO4 + 2H2O,
окислитель – MnO2.
MnO2 + NaBiO3 + HNO3 → HMnO4 + BiONO3 + NaNO3 + H2O,
| MnO2 + 2H2O –3ē → MnO4– + 4H+ | ||||
| NaBiO3 + 4H+ +2ē → BiO+ + Na+ + 2H2O | ||||
| 2MnO2 + 4H2O + 3NaBiO3 + 12Н+ → 2МnО4– +8H+ + 3BiO+ + 3Na+ + 6H2O 2MnO2 + 3NaBiO3 + 6HNO3 = 2HMnO4 + 3BiONO3 + 3NaNO3 + 2H2O | ||||
Восстановитель – MnO2.
У соединений, содержащих d-элемент в низшей положительной степени окисления (+1, +2), преобладают восстановительные свойства, например, гидроксид железа (II) легко окисляется на воздухе:
4Fe(OH)2 + О2 + 2Н2О = 4Fe(OH)3
| Fe(OH)2 + OH– –ē → Fe(OH)3 | ||
| O2 + 2H2O +4ē → 4OH– | ||
| 4Fe(OH)2 + О2 + 2Н2О = 4Fe(OH)3 |
Восстановитель – Fe(OH)2.
Некоторые соединения d-элементов в промежуточной степени окисления способны к диспропорционированию (самоокислению-самовосстановлению).
3K2МnO4 + 2Н2О = 2KMnO4 + MnO2 + 4KOH
| MnO42– –ē → MnO4– | ||
| MnO42– + 2H2O +2ē → MnO2 + 4OH– | ||
| 3MnO42– + 2H2O = 2 MnO4– + MnO2 + 4OH– |
Окислительно-восстановительные свойства соединений d-элементов зависят от их устойчивости. С повышением устойчивости соединений в высшей степени окисления их окислительные свойства ослабевают:
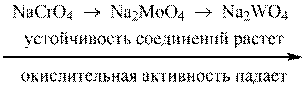
Особым свойством d-элементов является их способность к комплексообразованию.
Контрольные вопросы
1. Опишите особенности электронного строения металлов побочных подгрупп.
2. Опишите общие физические свойства d-элементов.
3. Охарактеризуйте окислительно-восстановительные свойства соединений d-металлов в различных степенях окисления.
4. Проанализируйте изменение прочности связи Mn–O в оксидах: MnO, Mn2O3, MnO2, Mn2O7.
4. Охарактеризуйте изменение кислотно-основных свойств соединений d-металлов с повышением степени окисления элемента.
5. Рассмотрите способы получения d-металлов.
Примеры выполнения заданий
Пример 1. Выполнение задания 1 разобрано в главе 3 (пример 1).
Пример 2. Какими кислотно-основными свойствами обладают следующие соединения d-металлов: CrO3, Zn(OH)2, Fe(OH)2?
Решение.
Поскольку многие d-металлы могут проявлять переменную степень окисления, то характер их соединений может меняться с увеличением степени окисления от основного через амфотерный к кислотному. По определению, к основным оксидам относят оксиды металлов в степени окисления +1, +2, им соответствуют гидроксиды – основания. Основные оксиды и гидроксиды взаимодействуют с кислотами, образуя соль и воду. К кислотным оксидам относят оксиды неметаллов и металлов в степени окисления ³ +4, им соответствуют гидроксиды – кислоты. Кислотные оксиды и кислоты взаимодействуют с основаниями с образованием соли и воды. Амфотерные соединения (оксиды и гидроксиды Be2+, Al3+, Zn2+, Sn2+, Pb2+, Cr3+) проявляя двойственный характер, взаимодействуют и с кислотами и со щелочами CrO3 – кислотный оксид, хром находится в своей высшей степени окисления +6.
CrO3 + 2NaOH = Na2CrO4 + H2O
CrO3 + 2OH– = CrO42– + H2O
2) Zn(OH)2 – амфотерный гидроксид.
а) Zn(OH)2 + H2SO4 = ZnSO4 + H2O
Zn(OH)2 + 2H+ = Zn2+ + H2O
б) Zn(OH)2 + 2KOH = K2[Zn(OH)4]
Zn(OH)2 + OH– = [Zn(OH)4]2–
Fe(OH)2 – основной гидроксид, железо находится в своей низшей положительно степени окисления +2.
Fe(OH)2 + 2HCl = FeCl2 + 2H2O
Fe(OH)2 + 2H+ = Fe2+ + 2H2O.
Пример 3. Выполнение задания 3 разобрано в главе 8 (пример 5).
Задания для самостоятельной работы
Задание 1.Составьте полные электронные формулы и графические формулы валентного слоя элементов d-семейства:
| Вариант | ||||||||
| Элемент № | 21,84 | 28,80 | 23,78 | 25,76 | 24,77 | 27,74 | 40,73 | 42,75 |
| Вариант | ||||||||
| Элемент № | 45, 30 | 22,79 | 44,72 | 29,41 | 26,41 | 47,57 | 48,89 |
Задание 2.Составьте формулы оксида и гидроксида металла в указанной степени окисления. Приведите уравнения реакций, демонстрирующие кислотно-основной характер этих соединений.
| Вариант | ||||||||
| Металл | V+5 | Mn+2 | Cr+3 | Fe+2 | Ni+2 | Cu+ | Mn+7 | |
| Вариант | ||||||||
| Металл | Cr+6 | Ag+ | Cu2+ | Cr+2 | W+6 | Mo2+ | Zn+2 | Mo+6 |
Задание 3.Расставьте коэффициенты в приведенных схемах ОВР, пользуясь методом полуреакций. Укажите, какую роль в приведенных окислительно-восстановительных реакциях играют соединения d-металлов, в какой степени окисления при этом находится металл?
| Вариант | Схемы реакций |
| Fe(OH)2 + O2 + H2O ® Fe(OH)3 KMnO4 + KI + H2SO4 ® I2 + MnSO4 + K2SO4 + H2O | |
| KMnO4 + KI + H2O ® I2 + MnO2 + KOH Co2O3 + HCl(конц) ® CoCl2 + Cl2 + H2O | |
| KNO2 + K2Cr2O7 + HNO3 ® Cr(NO3)3 + KNO3 + H2O KMnO4 + KNO2 + KOH ® K2MnO4 + KNO3 + H2O | |
| KMnO4 + Cr2(SO4)3 + KOH ® K2CrO4 + K2MnO4 + H2O + K2SO4 FeCl3 + KOH + Br2 ® K2FeO4 + KBr + H2O + KCl | |
| K2FeO4 + NH3 ® N2 + H2O + KFeO2 + KOH K2Cr2O7 + KI + H2SO4 ® Cr2(SO4)3 + I2 + H2O + K2SO4 | |
| KMnO4 + H2O2 + H2SO4 ® MnSO4 + O2 + K2SO4 + H2O FeCl3 + KI ® FeCl2 + I2 + KCl | |
| K2Cr2O7 + SO2 + H2SO4 ® Cr2(SO4)3 + K2SO4 + H2O MnO2 + HCl ® MnCl2 + Cl2 + H2O | |
| Cr2(SO4)3 + PbO2 + KOH ® K2CrO4 + PbSO4 + H2O KMnO4 + H2O + KNO2 ® MnO2 + KNO3 + KOH | |
| KMnO4 + Na2SO3 + H2SO4 ® K2SO4 + MnSO4 + H2O + Na2SO4 Cr2O3 + NaOH + KNO3 ® Na2CrO4 + KNO2 + H2O | |
| KMnO4 + Na2SO3 + NaOH ® K2MnO4 + Na2SO4 + H2O FeSO4 + K2Cr2O7 + H2SO4 ® Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + H2O | |
| Cr(OH)3 + Br2 + KOH ® K2CrO4 + KBr + H2O KMnO4 + KOH + KNO2 ® K2MnO4 + KNO3 + H2O | |
| K2Cr2O7 + H3PO3 + H2SO4 ® Cr2(SO4)3 + H3PO4 + K2SO4 KMnO4 + K2SO3 + H2O ® MnO2 + K2SO4 + KOH | |
| KMnO4 + H2S + H2SO4 ® MnSO4 + S + K2SO4 + H2O Sn + HNO3(р) ® Sn(NO3)2 + NH4NO3 + H2O | |
| PH3 + CuSO4 + H2O ® H3PO4 + Cu + H2SO4 K2Cr2O7 + SnCl2 + HCl ® SnCl4 + CrCl3 + KCl + H2O | |
| FeCl3 + SO2 + H2O ® FeCl2 + H2SO4 + HCl KNO2 + K2Cr2O7 + HNO3 ® Cr(NO3)3 + KNO3 + H2O |
Тестовые задания для самоконтроля
1. При добавлении раствора … к раствору сульфата меди не будет выпадать осадок.
1) NaOH,
2) Na2S,
3) NaCl.
2. Область значения рН для раствора хлорида меди:
1) рН > 7,
2) рН ≈ 7,
3) рН < 7.
3. Сумма стехиометрических коэффициентов в уравнении реакции: Zn + NaOH + H2O → ….:
1) 6,
2) 7,
3) 8.
4. Геометрическая конфигурация катиона [Zn(NH3)4]2+ -
1) линейная,
2) плоская,
3) тетраэдр.
5. Сумма стехиометрических коэффициентов в уравнении реакции: Cr + Cl2 → ….:
1) 3,
2) 5,
3) 7.
6. Степень окисления хрома в продуктах термического разложения Cr(OH)3 -
1) +2,
2) +3,
3) +6.
7. Сумма стехиометрических коэффициентов в уравнении реакции: Mn + HCl → …:
1) 3,
2) 5,
3) 7.
8. Сумма стехиометрических коэффициентов в уравнении реакции: KMnO4 + H2SO4 + K2SO3 → …:
1) 15,
2) 18,
3) 21.
9. Окраска лакмуса в растворе хлорида железа (III) –
1) красная,
2) фиолетовая,
3) синяя.
10. В результате окислительно-восстановительной реакции: K2MnO4 + H2O → … степень окисления марганца будет…
1) не изменится,
2) +2, +4,
3) +4, +7.
Ответы к тестовым заданиям
| № вопроса | ||||||||||
| № ответа |
Лабораторная работа № 11
Химические свойства соединений d-металлов
Цель работы: изучение химических свойств d-элементов, обусловленных особенностями электронного строения их атомов.
Реактивы: V2O5, MnO2; NaBiO3 (тв.), лакмус, Br2 (р-р), Н2О2 (3%), 1% раствор крахмала, HNO3 (конц.); 2 н. растворы: NaOH, H2SO4, СН3СООН; 0,5 н. растворы MnSO4, СоSO4, NiSO4, Cr2(SO4)3, KI, К2Сr2О7, K2CrO4; свежеприготовленный раствор FeSO4 из соли Мора (NH4)2·FeSO4·6Н2О.
Оборудование: капельницы с пипетками, штатив с пробирками, газовая горелка, держатель, микрошпатель, стеклянная палочка.
Техника безопасности: Опыт 1в выполняйте под тягой. Осторожно нагревайте пробирки с растворами на пламени горелки.
Ход работы
Опыт 1. Соединения d-элементов низшей степени окисления
а) Основные свойства гидроксидов
В пробирки внесите по 10 капель растворов MnSO4, NiSO4. В каждую из них прибавьте 2 н раствор щелочи до образования осадка. Отметьте цвета осадков. Испытайте все полученные гидроксиды на растворимость в кислоте и в избытке щелочи. Составьте молекулярные и ионные уравнения соответствующих реакций.
Какой вывод можно сделать о кислотно-основных свойствах гидроксидов d-элементов в степени окисления +2?
б) Восстановительные свойства соединений
В две пробирки внесите по 20 капель 2 н растворов FeSO4, NiSO4, в третью – 5 капель раствора СоSO4. В каждую пробирку добавьте 2 н раствор щелочи до образования соответствующего гидроксида (II). В третьей пробирке голубой осадок соответствует основной соли кобальта (II), а розовый цвет – гидроксиду кобальта (II).
Первую пробирку с осадком оставьте стоять на воздухе. Что наблюдаете? Напишите реакцию окисления гидроксида железа (II) в гидроксид железа (III) кислородом воздуха.
Осадок гидроксида кобальта, предварительно размешав стеклянной палочкой, разделите на две части. Одну оставьте стоять на воздухе. Ко второй части прилейте 3%-ного раствора Н2О2. В какой из пробирок наблюдается окисление гидроксида кобальта (II)? Напишите уравнение реакции.
Осадок гидроксида никеля разделите на три части. Одну оставьте стоять на воздухе, ко второй прилейте 20 капель 3%-ного раствора H2O2, а к третьей 10 капель бромной воды. В какой из пробирок наблюдается окисление гидроксида никеля (II) в гидроксид никеля (III)? Напишите уравнение реакции. На основании результатов опыта сделайте вывод: как изменяется восстановительная активность в ряду: Fe2+ → Со2+ → Ni2+?
Опыт 2. Соединения d-элементов в промежуточной степени окисления
Амфотерные свойства гидроксидов
а) В пробирку внесите 20 капель раствора Cr2(SO4)3 и прибавляйте по каплям 2 н раствора щелочи до образования осадка. Осадок разделите поровну в две пробирки. Затем в одну из пробирок прилейте 2 н раствора H2SO4, а в другую – 2 н раствора NaOH до полного растворения осадка.
Какими свойствами обладает Сr(ОН)3? Напишите молекулярные и ионные уравнения всех реакций, учитывая, что в избытке щелочи при растворении гидроксида хрома (III) образуется комплексная соль Na3[Cr(OH)6] – гексагидроксохромат (III) натрия.
Окислительно-восстановительные свойства МnО2
б) В две пробирки внесите по 1/2 микрошпателя твердого МnO2. В первую из них добавьте по 20 капель 2 н раствора H2SO4 и иодида калия. Наблюдайте изменение окраски раствора на красно-бурую, обусловленное выделением свободного йода. Во вторую пробирку добавьте 20 капель азотной кислоты и на кончике микрошпателя висмутата натрия NaBiO3. Дайте раствору отстояться. Чем обусловлено появление розовой окраски во второй пробирке? Напишите уравнения соответствующих окислительно-восстановительных реакций и схемы полуреакций. Какие окислительно-восстановительные свойства проявляет оксид марганца (IV) в этих реакциях?
Опыт 3. Соединения d-металлов высшей степени окисления
а) Кислотные свойства оксидов
В пробирку внесите 1/2 микрошпателя порошка оксида ванадия (V) V2O5 и 20 капель дистиллированной воды. Смесь нагрейте на газовой горелке до появления бледно-желтой окраски НVО3. Дайте раствору отстояться, затем проверьте среду универсальным индикатором. Определите рН среды. Напишите уравнение реакции получения метаванадиевой кислоты HVO3.
б) Взаимопревращение хромат и дихромат ионов
В пробирку внесите 10 капель раствора K2СrO4 и 2 н H2SO4 до изменения желтой окраски в оранжевую.
В другую пробирку внесите 10 капель раствора K2Сr2O7 и 2 н раствор щелочи до перехода окраски из оранжевой в желтую.
Хромат и дихромат ионы способны к взаимопревращению в зависимости от среды. Напишите уравнения реакций.
в) Окислительные свойства соединений
В пробирку налейте 20 капель дихромата калия K2Сr2O7, добавьте 10 капель 2 н раствора серной кислоты и 10 капель раствора KI. Составьте уравнение реакции, учитывая, что ион Сг2О72– восстанавливается до Сr3+. Красно-бурая окраска раствора обусловлена выделением свободного йода. Добавьте 2-3 капли раствора крахмала. Как изменяется окраска раствора?
