Опыт 3. Определение общей жесткости водопроводной воды методом комплексонометрического титрования
Комплексонометрическим титрованием (комплексонометрией) называют титриметрический метод количественного анализа, основанный на аналитическом использовании реакций комплексообразования ионов металла с полидентантными хелатообразующими органическими реагентами – комплексонами. В аналитической химии наиболее часто применяют комплексон (III), двунатриевую соль этилендиаминтетрауксусной кислоты (ЭДТА), Na2H2Y,
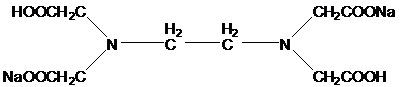 .
.
Для краткости обозначим анион ЭДТА как Y4–, тогда уравнение реакции комплексообразования, например, с двухзарядными ионами металлов будет иметь вид
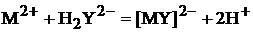 .
.
Вне зависимости от заряда иона металла комплексообразователя всегда образуются комплексы состава 1:1. 1 Моль эквивалентов ЭДТА всегда взаимодействует с 1 моль эквивалентов металла. Отсюда следует, что 1 моль эквивалентов ЭДТА в реакциях комплексообразования равен его молярной массе, а 1 моль эквивалентов металла должен быть численно равен атомной массе металла, вступающего в реакцию с 1 молем ЭДТА.
Жесткость воды это совокупность свойств, обусловленная наличием в ней катионов кальция Са2+ и магния Mg2+. Сумму концентраций Са2+ и Mg2+ называют общей жесткостью. Величину жесткости выражают в ммоль экв/дм3 или в моль экв/м3.
Обычно общую жесткость определяют титрованием стандартным раствором ЭДТА. В этом случае жесткость рассчитывают по уравнению
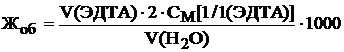 моль экв/м3.
моль экв/м3.
Реактивы и оборудование. Титрант – стандартный раствор ЭДТА c концентрацией C(ЭДТА) = 0,025 моль/дм3; коническая колба для титрования объемом 250 см3; пипетка на 10,00 см3; бюретка объемом 25 см3; индикатор эриохромовый черный Т; аммиачный буфер рН = 10.
Выполнение работы. Определяют общую жесткость водопроводной воды. Техника титрования описана в разделе 3. Готовят бюретку для титрования и заполняют ее стандартным раствором ЭДТА. Мерным цилиндром отбирают 50,0 см3 водопроводной воды и переносят ее в колбу для титрования и приливают 1 см3 аммиачного буфера рН = 10. Добавляют на кончике шпателя кристаллы индикатора и начинают титрование. Последние порции ЭДТА приливают по каплям. Титрование останавливают в тот момент, когда произойдет резкий переход окраски от фиолетовой к синей. Записывают объем раствора ЭДТА, пошедший на титрование. Повторяют титрование еще 3 раза. Перед каждым титрованием коническую колбу моют и ополаскивают дистиллированной водой.
Примечания
1. Буферный раствор приливают обязательно перед добавлением индикатора.
2. Индикатора не следует добавлять слишком много, иначе окраска изменяется медленно и раствор оказывается перетированным.
Запись данных опыта и расчеты. Данные записать по приведенной ниже форме.
Концентрация титранта CМ(ЭДТА) = 0,025 моль/дм3
Индикатор – эриохромовый черный Т
| № п/п | Объем воды V(Н2О), см3 | Эквивалентный объем титранта V(ЭДТА), см3 |
По результатам титрования найти средний объем титранта 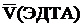 =
=
Рассчитать общую жесткость воды по уравнению
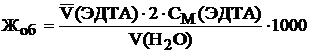 =
=
Контрольные вопросы
1. Дайте определение понятию «массовая доля растворенного вещества».
2. Дайте определение молярной концентрации и молярной концентрации эквивалента.
3. Вычислите молярные массы эквивалентов и факторы эквивалентности в реакциях полной нейтрализации следующих веществ: HNO3; NH3; H2SO4; KHSO4; Na2CO3.
4. Рассчитайте количество HNO3 для нейтрализации 5,3 г Na2CO3.
5. Что такое жесткость воды, как ее рассчитать.
6. В чем сущность метода определения жесткости воды титрованием?
7. Рассчитайте общую жесткость воды, если в 100 дм3 содержится 4 г ионов Са2+ и 2,4 г ионов Mg2+.
3. ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ
Химические процессы протекают с изменением энергетического состояния веществ (сопровождаются выделением или поглощением теплоты) и упорядоченности их строения. Для анализа этого аспекта химического взаимодействия используют понятие «система». Системой называется совокупность тел, находящихся во взаимодействии и мысленно выделенных из окружающей среды. Термодинамика изучает свойства макроскопических систем на основе возможных превращений энергии без рассмотрения их микросостояний. Важнейшим результатом термодинамического исследования предполагаемых изменений в системе является вывод о возможности или невозможности самопроизвольного протекания процесса в выбранных условиях.
Если вопрос о возможности протекания реакции решен, возникает проблема оценки скорости реакции и возможности управления ею. Этот аспект химического взаимодействия изучает химическая кинетика – учение о скоростях и механизме реакций.
Ниже обсуждены важнейшие термодинамические и кинетические характеристики и закономерности протекания химических процессов и дано описание опытов, позволяющих исследовать их экспериментально.
