Тема 2:Буферные системы и их роль в организме человека
Дайте краткий ответ на теоретические вопросы:
1.Расчет рН буферных систем.
Ответы:
Для расчета рН в буферном растворе на примере ацетатного буфера рассмотрим процессы, в нем протекающие, и их влияние друг на друга.
Ацетат натрия практически полностью диссоциирует на ионы, ацетат-ион подвергается гидролизу, как ион слабой кислоты:
CH3COONa ⇄ Na+ + CH3COO–
CH3COO– + HOH ⇄ CH3COOH + OH–
Уксусная кислота, также входящая в буфер, диссоциирует лишь в незначительной степени:
CH3COOН ⇄CH3COO– + H+
Слабая диссоциация СН3СООН еще более подавляется в присутствии СН3СООNa, поэтому концентрацию недиссоциированной уксусной кислоты принимаем практически равной ее начальной концентрации:
[СН3СООН] = [кислота]
С другой стороны, гидролиз соли также подавлен наличием в растворе кислоты. Поэтому можно считать, что концентрация ацетат-ионов в буферной смеси практически равна исходной концентрации соли без учета концентрации ацетат-ионов, образующихся в результате диссоциации кислоты:
[СН3СОО–] = [соль]
Согласно закону действующих масс, равновесие между продуктами диссоциации уксусной кислоты и недиссоциированными молекулами подчиняется уравнению:
Кд = 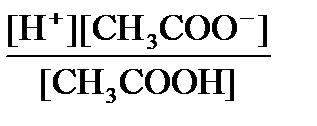 .
.
Подставив общую концентрацию кислоты и соли в уравнение константы диссоциации, получим: [Н+] = Кд 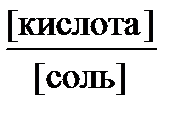 ,отсюда для кислотных буферных систем: рН = рК(кислоты) + lg
,отсюда для кислотных буферных систем: рН = рК(кислоты) + lg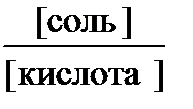 .Это уравнение называют уравнением Гендерсона – Гассельбаха.
.Это уравнение называют уравнением Гендерсона – Гассельбаха.
После аналогичного вывода для основных буферных систем:
рОН = рК(основания) + lg 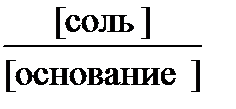 ,рН =14 – рК(основания) – lg
,рН =14 – рК(основания) – lg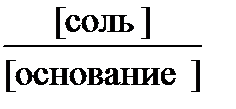
рК(кислоты), рК(основания) - отрицательный десятичный логарифм константы электролитической диссоциации слабой кислоты; слабого основания; [соль] - концентрация соли, [кислота] - концентрация кислоты, [основание] - концентрация основания.
Из этих уравнений видно, что рН кислотной (основной) буферной системы зависит от природы слабого электролита (рК(кислоты), рК(основания)) и от соотношения концентраций соли и кислоты (основания).
Следует отметить, что буферные системы эффективно поддерживают рН в диапазоне:рК(кислоты)± 1 для кислотных систем; 14 – (рК(основания)± 1) для основных систем.
2.Основные определения: буферные системы, компоненты буферной системы.
Ответы:
Буферные системы – это растворы способные сохранять постоянной концентрацию ионов Н+ при добавлении к ним небольших количеств сильной кислоты или щелочи.
КЛАССИФИКАЦИЯ БУФЕРНЫХ СИСТЕМ
1. Кислотные. Состоят из слабой кислоты и соли этой кислоты. Например, ацетатная буферная система (CH3COOH/СН3СООNa), гидрокарбонатная буферная система (H2CO3 /NaHCO3).
2.Основные.Состоят из слабого основания и его соли. Например, аммиачная буферная система (NH3×H2O/NH4Cl).
3. Солевые. Состоят из кислой и средней соли или двух кислых солей. Например, карбонатная буферная система (NaHCO3/Na2CO3), фосфатная буферная система (КН2PO4/К2НPO4).
4. Аминокислотные и белковые.Если суммарный заряд молекулы аминокислоты или белка равен нулю (изоэлектрическое состояние), то растворы этих соединений не являются буферными. Их буферное действие начинает проявляться тогда, когда к ним добавляют некоторое количество кислоты или щелочи. Тогда часть белка (аминокислоты) переходит из изоэлектрического состояния в форму “белок-кислота” или соответственно в форму “белок-основание”. Образуется смесь двух форм белка: а) слабая “белок-кислота” + соль этой слабой кислоты; б) слабое “белок- основание” + соль этого слабого основания:

где R - макромолекулярный остаток белка.
Решите задачи:
Задача 1
Концентрация [OH-] и рН в 0,003 молярном растворе СН3СООН равна:
(КСН3СООН = 1,85 • 10-5 моль/л; lg 2,36 = 0,36)
а) 4,36 б) 5,12 в) 3,64 г) 2,36
5,02 • 10-11 0,42 • 10-11 4,24 • 10-11 6,17 • 10-10
Решение:
Для одноосновных слабых кислот используем уравнение
[Н+] = √ КСН3СООН• Ск-ты = √ 1,85 • 10-5моль/л • 3 • 10-3моль/л =
= √ 5,55 • 10-8моль2/л2 = 2,36 • 10-4моль/л
[ОН-]= Кв = 10-14моль2/л2 = 4,24 • 10-11 моль/л
[Н+] 2,36 • 10-4моль/л
рН = - lg [H+] = - lg 2,36 • 10-4 = 4 – 0,36 = 3,64
Ответ: в
Задача№2
В лаборатории для проведения биохимических экспериментов требуется приготовить 100 мл фосфатного буферного раствора с pH = 7,2.
Вопросы:
1.Какой раствор называется буферным?
Буферные растворы— это растворы, величина рН которых мало изменяется при добавлении к ним небольших количеств сильных кислот или щелочей, а также при разбавлении.
2.Из каких компонентов состоит фосфатная буферная система?
Фосфатная буферная система представляет собой сопряженную кислотно-оснóвную пару Н2РО4–/НРО42–.
3.К какому типу буферных систем относится фосфатный буфер?
Относится к типу кислотные буферные системы.
4.По какой формуле вычисляется pH фосфатного буферного раствора?
для фосфатного буфера уравнение Гендерсона-Гассельбаха запишется следующим образом:
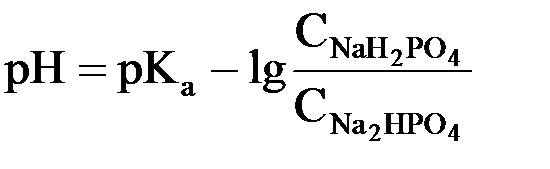
(в данной системе роль слабой кислоты играет анион Н2РО4–, то 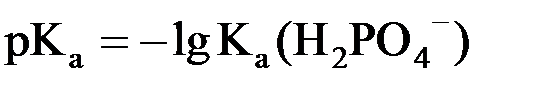 .
.
5.В каких объемных соотношениях надо смешать исходные растворы компонентов фосфатной буферной системы, молярная концентрация которых 0,1 моль/л, чтобы приготовить 100 мл буферного раствора с pH = 7,2, если pKa(H3PO4) = 1,9; pKa(H2PO4-) = 7,2; pKa(HPO42-) = 12,3?
Ответьте на тесты:
1. В состав крови не входит буферная система
ацетатная
2. Наибольшей буферной ёмкостью в плазме крови обладает буферная система
гидрокарбонатная
3. Постоянство водородного показателя различных сред и тканей человеческого организма называется
кислотно-основным состоянием
4. Участвует в процессах дыхания и поддержании водородного показателя крови
гемоглобин-оксигемоглобиновая
Занятие №3
