Связь пространственного строения с биологической активностью. Представление о стереоспецифичности биохимических процессов и стереоспецифичности действия лекарственных веществ.
В организме реакции протекают с участием биокатализаторов – ферментов. Ферменты построены из хиральных молекул α-аминокислот. Поэтому они могут играть роль хиральных реагкнтов, чувствительных к хиральности взаимодействующих с ними субстратов. Таким образом, пространственное строение молекул связано со стереоспецифичностью биохимических процессов.
Стереспецифичность процессов, протекающих в организме, состоит в том, что в реакцию вовлекаются определенные стереизомеры и результатом реакции являются также стереохимически ориентированные продукты.
Стереоспецифичность лежит в основе проявления биологического действия одним из энантиомеров, в то время как другой энантиомер может быть неактивным, а иногда оказывать иное или даже противоположное действие.
Многие лекарственные вещества проявляют фармакологический эффект при взаимодействии с рецепторами клетки. Для этого необходимо, чтобы молекула лекарственного вещества имела такую конфигурацию, которая позволяла бы наиболее полно связываться с рецептором. Изменение конфигурации на противоположную, как правило, снижает степень связывания и ослабляет биологическое действие. Например, из двух энантиомеров адреналина наибольшую гормональную активность проявляет левовращающий адреналин, являющийся (R)-изомером (рис. 5, а). У правовращающего энантиомера — (S)-адреналина — ОН-группа ориентирована в пространстве иначе и не взаимодействует с рецептором (рис. 5, б). Этот энантиомер адреналина способен связываться не с тремя, а только с двумя точками рецептора, что приводит к ослаблению фармакологического действия. Это подтверждается тем фактом, что пониженная активность (+)-адреналина сравнима с активностью, проявляемой дезоксиадреналином, не содержащим ОН-группы.
8.Типы химических связей в органических соединениях. Ковалентные s- и p- связи. Строение двойных (С=С, С=О, С=N) и тройных (С=С, С=N) связей, их основные характеристики.
Химическая связь – совокупность взаимодействий между электронами и ядрами, приводящих к соединению атомов в молекулу.
Основным типом химических связей в органических соединениях являются ковалентные связи.
Ковалентной называется химическая связь, образованная за счет обобществления электронов связываемых атомов. Существует два типа ковалентной связи: s-связь и p-связь.
s-Связь – это одинарная ковалентная связь, образованная при перекрывании АО по прямой (оси), соединяющей ядра двух связываемых атомов с максимумом перекрывания на этой прямой.
p-Связь – это связь, образованная при боковом перекрывании негибридизованных р-АО с максимумом перекрывания над и под плоскостью s-связей.
Встречающиеся в органических соединениях простые ковалентные связи могут быть только s-типа, а кратные связи представляют собой комбинацию s- и p-связей. Так, двойная связь состоит из одной s- и одной p-связей, а тройная – из одной s- и двух p-связей.
Свойства ковалентной связи выражаются через ее количественные характеристики – длину, энергию, полярность, поляризуемость.
Длина связи – это расстояние между центрами связанных атомов. Длина связей зависит от состояния гибридизации атома углерода. Так, двойная связь короче одинарной, а тройная – короче двойной.
Энергия связи – это энергия, которая выделяется при образовании связи, или энергия, которую необходимо затратить, чтобы разорвать связь.
Полярность связи – обусловлена неравномерным распределением электронной плотности. Она обусловлена разной электроотрицательностью связывающихся атомов.
Электроотрицательность – это способность атома в молекуле удерживать валентные электроны. Для описания электроотрицательности атомов используют шкалу Полинга.
Поляризуемость связи выражается в смещении электронного облака по отношению к ядрам под влиянием внешнего электромагнитного поля. По поляризуемости p-связь значительно превосходит s-связь. Поляризуемость в значительной мере определяет реакционную способность молекул.
Донорно-акцепторная или координационная связь – это ковалентная связь, образованная за счет пары электронов одного атома. Донорно-акцепторные связи характерны для комплексных соединений. Разновидностью донорно-акцепторной связи является семиполярная связь, например в нитрогруппе. Семиполярная связь является сочетанием ковалентной и ионной связей.
Водородная связь – связь между атомом водорода и сильно электроотрицательным элементом (азотом, кислородом, фтором, хлором). Водородные связи могут быть внутримолекулярными и межмолекулярными. Водородные связи влияют на физические и химические свойства веществ. Водородные связи играют важную роль в формировании пространственной структуры высокомолекулярных соединений – белков, полисахаридов, нуклеиновых кислот.
9.Делокализованная химическая связь. π-p и p-p сопряжение.
Связь делокализованная (или многоцентровая) - полярная ковалентная химическая связь, молекулярные орбитали которой включают более двух атомов [электронная пара рассредоточена между несколькими (более двух) ядрами атомов, т.е. наподобие металлической связи]. Многоцентровые делокализованные связи характерны для многоатомных молекул. Вследствие делокализации порядок связей в системе часто становится нецелочисленным. В большинстве делокализованные связи являются π-связями, характерными для сопряженной системы (например, CH2ΞCH-CH=CH2), т.е. делокализация (рассредоточение) электронов характерна для кратных π-связей, чередующихся с одинарными. Как многоцентровая такая связь может быть:
* 3-центровая связь - у которой три атома-центры связаны двумя электронами. Такая связь образуется, например, при взаимодействии валентной орбитали атома, занятой неспаренной электроном, с двумя валентными орбиталями двух атомов лигандов, занятых одним электроном. 3-центровые связи могут возникать также в соединениях бора с водородом [например, в молекуле диборана (В2Н6) атомы водорода соединены 3-центровыми связями в результате перекрывания sp3-гибридных орбиталей двух атомов бора с 1s-атомной орбиталью атома водорода] или между тремя атомами бора. 3-центровые связи обладают меньшей энергией чем обычная 2-центровая связь.
Молекулярные орбитали таких связей содержат:
- одну связывающую орбиталь (занята двумя электронами)
- одну вакантную несвязывающую орбиталь
- одну вакантную разрыхляющую орбиталь
Трехцентровая двухэлектронная связь является электронодефицитной - образованной за счет обобществления одного электрона ядрами атомов бора и водорода ('нормальным' случаем является наличие двух электронов на два атома), например, в диборане В2Н6 c мостиковой структурой (характерной для электронодефицитных молекул): в диборане таких связей две, что обеспечивает определенную прочность димера
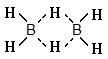
(четыре атома водорода и два атома бора лежат в одной плоскости, а 'мостиковые' атомы водорода расположены над и под этой плоскостью).
3-центровые связи могут быть открытого/закрытого типа, а также 2-х или 4-электронные (при этом занимается несвязывающая орбиталь), например, в анионе (HF2-); цифра показывает число электронов в молекуле на трех молекулярных орбиталях в результате 3-центрового взаимодействия, причем только одна из орбиталей рассматривается как связывающая). Упомянутые электроны (2 или 4 шт.) практически неразличимы с неподеленными парами электронов рассматриваемых атомов.
Примеры агентов с 3-центровыми связями: диборан (B2H6), нитрит-анион (NO2-) и др.
3-центровая 4-электронная связь присутствует, например, в соединении KI3, у которого анион иода связан с молекулой иода
* 4-центровая связь - присутствует, например, между азотом и кислородом в молекуле кислоты (HONO2), в ионе (NO3) и в димере (Al2Cl6)
* 5-центровая связь - присутствует, например, в молекуле (B6H9)
Примечания:
* К электронодефицитным системам относятся и катион-радикалы, образующиеся при электрохимическом окислении
* Электроноизбыточные элементы образуют соединения с ковалентными связями. К ним относятся анион-радикалы и системы на основе три- и тетракарбонильных соединений
Делокализованная связь - это ковалентная связь, молекулярная орбиталь которой охватывает более двух атомов.
Делокализованные связи в большинстве случаев являются π-связями. Они характерны для сопряженных систем. В этих систе- мах осуществляется особый вид взаимного влияния атомов - сопряжение.
Сопряжение (мезомерия, от греч. mesos - средний) - это выравнивание связей и зарядов в реальной молекуле (частице) по сравнению с идеальной, но не существующей структурой.
Участвующие в сопряжении делокализованные р-орбитали могут принадлежать либо двум π-связям и более, либо π-связи и одному атому с р-орбиталью. В соответствии с этим различают π,π-сопряжение и ρ,π-сопряжение. Система сопряжения может быть открытой или замкнутой и содержать не только атомы углерода, но и гетероатомы.
Сопряжение может быть π-p - сопряжением и p-p - сопряжением.
π-p - сопряжение – сопряжение, в которое вступили только орбитали p - связей, к системам с таким видам сопряжения относятся алифатические цепи, содержащие двойные связи, альфа ветта-карбонильные соединения и арены, и их производные шестичленные гетероциклические соединения с одним или двумя гетероатомами (пиридин, пиримидин).
p-p - сопряжение в которое вступили орбитали p-связей и p-орбиталь гетероатома, к ним относятся алифатические соединения, содержащие фрагмент – CH=CH-X, пятичленные гетероциклические соединения (пиррол, тиофен, фуран, имидазол).
