Электронное строение атома. Закономерности изменения свойств элементов и их соединений.
Система четырех квантовых чисел позволяет определить число возможных состояний электрона в атоме в зависимости от уровня и подуровня, на котором он находится.
Согласно принципа (запрета) Паули в атоме не может быть двух и более электронов с четырьмя одинаковыми квантовыми числами.
Электроны, имеющие одинаковые значения n, ℓ и mℓ отличающиеся спиновым квантовым числом ms, образуют орбиталь, которая условно обозначается символом . Орбиталь—это область пространства, в которой пребывание электрона является наиболее вероятным, а следовательно, электронное облако отличается максимальной плотностью.
Правило Гунда заключается в том, что при заполнении орбиталей с одинаковой энергией электроны располагаются так, чтобы суммарный спин их был максимальным.
При переходе от одного элемента к следующему в периодической системе электрон стремится занять состояние с минимальной энергией. Последовательность заполнения электронами энергетических уровней и подуровней в порядке возрастания их энергии подчиняется правилу М. В. Клечковского и имеет
следующий вид:
1s < 2s < 2p < зs < Зp < 4s < 3d< 4р < 5s < 4d< 5р < 6s < 5d (или 4f ) <6p
Атом не имеет строго определенных границ. За его радиус принимается расстояние от ядра до главного максимума плотности внешних электронных оболочек. С увеличением заряда ядра в периодах атомный радиус немонотонно уменьшается, а в группах увеличивается.
Энергия ионизации Еi — это энергия, необходимая для отрыва наиболее
слабо связанного электрона от атома, количественно выражается в кДж/моль
или эВ. Чем меньше энергия ионизации, тем легче атом отдает электрон при
образовании химической связи, т.е. элемент является более сильным восстановителем. Поэтому восстановительная способность нейтральных атомов с ростом заряда ядра в периоде уменьшается, а в главных подгруппах растет.
Энергия сродства к электрону Еср — энергия, выделяющаяся при присоединении электрона к нейтральному атому, количественно выражается в кДж/моль или эВ. Она определяет окислительные свойства несвязанных атомов. Чем больше электронное сродство, тем более сильным окислителем является данный элемент. Окислительной способностью не обладают нейтральные атомы с устойчивыми конфигурациями s2, s2p6. У остальных элементов в таблице Д.И. Менделеева окислительная способность нейтральных атомов повышается слева направо и снизу вверх.
Электроотрицательностью элемента (ЭО) называют меру относительной
способности атомов оттягивать на себя электроны при образовании химической связи. Она пропорциональна как энергии ионизации, так и энергии сродства к электрону. С ростом заряда в периодах электроотрицательность в общем растет, а в подгруппах уменьшается.
Периоды. Таблица состоит из 7 периодов. Первые три периода малые, последние четыре периода большие. Физический смысл номера периода заключается в том, что номер периода соответствует главному квантовому числу или количеству электронных уровней у всех элементов данного периода.
Ёмкость первого энергетического уровня равна двум электронам (N=2), следовательно, первый период состоит из двух элементов:
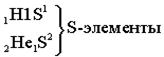 | S-элементами называют элемен- ты, у которых заполняются электронами S-подуровни. |
Ёмкость второго энергетического уровня N = 8. Длина второго периода составляет 8 элементов.
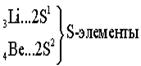
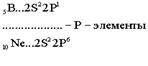
В силу первого закона Клечковского длина и строение третьего периода в точности повторяют второй: два s - элемента, шесть p - элементов. Каждый период начинается с двух s – элементов, которые, за исключением водорода и гелия, являются самыми активными металлами. Каждый период заканчивается активными неметаллами, за исключением благородных газов - химически инертых веществ.
Четвёртый период – первый большой период (18 элементов)
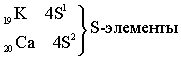
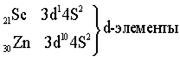
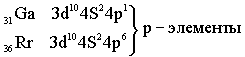
Пятый период. Длина и строение пятого периода в точности повторяет длину и строение четвёртого периода.
Шестой период. Лантан принимает первый электрон на подуровень 5d, затем, в соответствии со вторым законом Клечковского, заполнение электронами подуровня 5d приостанавливается, и начинает заполнятся электронами подуровень 4f.
| 58Сe | 4S1 5S2 5p6 5d1 6S2 | |
| 71Lu | 4f14 5S2 5p6 5d1 6S2 | |
| 72Hf | 5d2 6S2 | После заполнения электронами подуровня 4f продолжается заполнение подуровня 5d, снова появляются d-элементы. |
| 80Hg | 5d10 6S2 |
Заканчивается период шестью p-элементами. Таким образом, 6-й период имеет следующее строение: s – элементы – 2, d – элементы – 1, f – элементы – 14,d – элементы – 9, p – элементы – 6 / Всего 32 элемента. Седьмой период в точности повторяет длину и строение шестого периода. Все трансурановые элементы, начиная с 93Np, являются искусственными. В больших периодах характер изменения свойств элементов тот же, что и в малых, только замедленный. Все s – элементы, кроме Н и Не, - самые активные металлы. Все d и f – элементы тоже металлы, p – элементы частично металлы, частично неметаллы.
