Особенности электролиза водных растворов
При электролизе водных растворов электролитов электродные процессы становятся сложнее, к катоду мигрируют и затем могут разряжаться катионы электролита и водородные ионы, а к аноду перемещаются анионы электролита и гидроксид-ионы, которые также могут разряжаться. Кроме того, сами молекулы способны к электрохимическому окислению или восстановлению.
На катоде в первую очередь восстанавливаются катионы с наибольшим значением электродного потенциала, а на аноде, соответственно, окисляются анионы с наименьшим значением потенциала.
Реальные процессы электролиза также часто осложняются диффузией ионов к поверхности электродов, адсорбцией и десорбцией. Эти явления обуславливают кинетические затруднения, для преодоления которых следует затратить определенную энергию в виде добавочной ЭДС. Последняя называется перенапряжением и зависит от материала электродов, состояния их поверхности, от природы разряжающихся ионов.
Пример:
Водный раствор хлорида натрия содержит анионы: Cl-, катионы: Na+, а также молекулы воды.
Какие частицы будут окисляться на аноде и восстанавливаться на катоде?
Последовательность реакции на электродах различных ионов определяется:
1. Химической природой электродов
2. Окислительно-восстановительным (электродным) потенциалом реакции
Инертные электроды: Pt, графит в реакциях на электродах не участвуют.
Активные электроды: Cu, Fe, Zn, Ni… принимают активное участие в реакциях.
Например, в нашем случае:
Анод (окисление): Сu - 2e = Cu2+
φо= +0,34 В
Принципиально возможно восстановление на катоде следующих частиц:
1. Na+ + ē ® Na φо1= -2,7 В
2. 2H2O + 2ē ® H2+2OH - φо2= -0,83 В
Самый большой окислительно-восстановительный потенциал имеет 2 реакция. Поэтому на катоде будет восстанавливаться вода (реакция 2).
В нашем примере принципиально возможно окисление на аноде следующих частиц:
1. 2H2О - 4ē ® 4H+ + О2 φо1= +1,23 В
2. 2Cl- - 2ē ® Cl2 φо2= +1,36 В
φо1< φо2 , следовательно на аноде должна окисляться вода, однако на большинстве электродов окисляются хлорид-ионы.
Это связано с явлением, которое называется перенапряжение. Перенапряжение- добавочная по отношению к расчетной ЭДС, которую нужно приложить к электродам, чтобы осуществить окислительно-восстановительный процесс.
Таблица 12. Перенапряжения на некоторых электродах
| Электрод | Элетро-лит | Перенап-ряжение, В | Электрод | Электролит | Перенап-ряжение, В |
| Железо | Р-р HCl | 0,5 | Цинк | H2SO4 | |
| Серебро | Р-р HCl | 0,7 | Свинец | H2SO4 | 1,3 |
Процессы электролиза широко используются в промышленности. Электролизом расплавов и растворов получают многие металлы, газы (хлор, фтор, кислород, водород), а также производят рафинирование ряда металлов (меди, золота, никеля, серебра, олова и свинца), т.е. очищают их от вредных примесей. Электроосаждением на поверхности металлического изделия другого металла получают покрытия с высокими антикоррозионными, механическическими или декоративными свойствами. Так осуществляют хромирование, цинкование и никелирование. Если применять неметаллический катод, обладающий поверхностной проводимостью, то осаждаемый на нем металл затем легко отделяется. Подобным приемом можно получить точные металлические копии с рельефных предметов: матрицы для изготовления граммофонных пластинок, для тиснения бумаги и кожи, типографские клише.
Тема 2.2. Каталитические системы
Гомогенный и гетерогенный катализ
Катализаторы и каталитические системы. Сущность каталитического действия. Гомогенный катализ. Гетерогенный катализ. Методы повышения эффективности технологических процессов за счет использования катализаторов
При гомогенном катализе катализатор и реагирующие вещества образуют одну фазу (газовая смесь или раствор). При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах.
Адсорбционная теория гетерогенного катализа (ГК)
Описывает каталитические процессы, которые происходят на поверхности раздела твердой фазы (катализатор) и газовой фазы (реагирующие вещества). Центральную роль в процессе (ГК) играют физическая и химическая адсорбция.
Адсорбция
Адсорбция – накопление молекул на поверхности раздела фаз. Физическая адсорбция происходит под действием сил Ван-дер-Ваальса. Химическая адсорбция (хемосорбция) происходит вследствие образования химических связей между адсорбируемыми молекулами и поверхностью.
Стадии гетерогенного катализана примере каталитического гидрирования этилена
1. Диффузия. Реагирующие молекулы диффундируют к поверхности твердого вещества (см. рис. ).
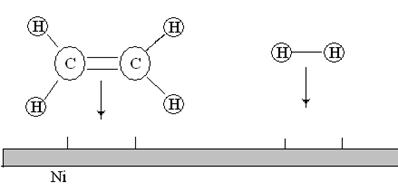
Рис.19. Диффузия молекул этилена и водорода из газовой фазы к поверхности никелевого катализатора
2. Адсорбция. Реагирующие молекулы сначала адсорбируются физически, затем вступают в химические реакции с активными центрами поверхности (хемосорбируются) (см. рис. ).
Активные центры – свободные участки поверхности, где могут адсорбироваться молекулы реагирующих веществ. Другая часть поверхности катализатора занята адсорбированными молекулами примесей. Число активных центров на единицу поверхности зависит от природы и способа приготовления катализатора.
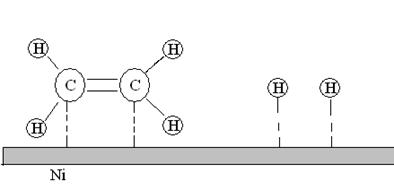
Рис.20. Адсорбция молекул этилена и водорода на поверхности никелевого катализатора
3. Химическая реакция. Адсорбированные атомы и молекулы вступают в химическую реакцию с образованием продуктов.
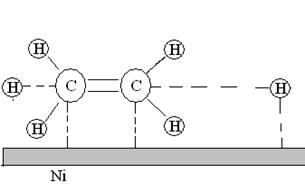
Рис. 21. Химическое взаимодействие молекул этилена и водорода на поверхности никелевого катализатора
5. Десорбция. Молекулы продуктов реакции переходят из состояния хемосорбированности в состояние физической адсорбированности и затем десорбируются с поверхности.
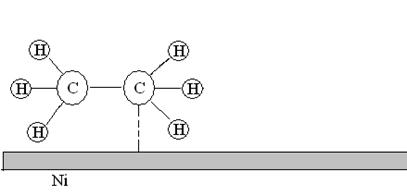
Рис. 22. Десорбция молекул этана с поверхности никелевого катализатора
5. Диффузия. Молекулы продуктов реакции диффундируют с поверхности.
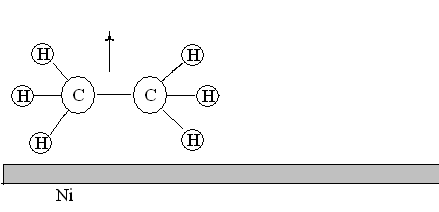
Рис. 23. Диффузия молекул этана с поверхности никелевого катализатора в газовую фазу
