Термохимическое уравнение представляет собой уравнение химической реакции, в котором наряду с формулами веществ, участвующих в реакции, указан ее тепловой эффект.
Например: N2 + 3 H2 → 2 NH3 – 91,88 кДж
В термодинамике положительными считаются тепловые эффекты эндотермических реакций (при этом система получает тепло из окружающей среды) и отрицательными тепловые эффекты экзотермических реакций (система отдает тепло окружающей среде).
Существует и термохимическая система измерения тепловых эффектов, в которой положительными считаются тепловые эффекты экзотермических реакций, а отрицательными эндотермических. В этом случае знак теплового эффекта определяется с точки зрения наблюдателя находящегося вне системы.
Термохимические уравнения могут складываться, вычитаться, умножаться и делиться как уравнения алгебраические.Это позволяет решать многие важные задачи вычисления тепловых эффектов различных реакций без их практического проведения. При такого рода расчетах широко используются следствия из закона Гесса. Три наиболее часто применяющихся следствия приведены ниже:
1. Энтальпия реакции равна разности сумм энтальпий образования продуктов реакции и исходных веществ.
ΔH = ΣΔH обр.конечн. – ΣΔH обр.нач.
2. Энтальпия реакции равна разности сумм энтальпий сгорания исходных веществ и продуктов реакции.
ΔH = ΣΔH сгор.нач. – ΣΔH сгор.конечн.
3. Энтальпия реакции образования вещества равна энтальпии реакции разложения его до исходных веществ с обратным знаком.
ΔH обр. = –ΔH раз.
Использование тепловых эффектов химических реакций в технике и технологии. Определение калорийности топлив и продуктов питания
Количество тепла, выделяющееся при сгорании определенной массы топлива, определяется в специальном приборе – калориметрической бомбе. Это прочный стальной герметически закрывающийся сосуд, окруженный теплоизолирующей водяной рубашкой. Образец известной массы помещается внутри бомбы в атмосфере сжатого кислорода под давлением порядка 25· 105 Па.
Затем образец поджигают с помощью электрического запала. Тепло, выделяющееся в результате горения образца, поглощается в водяной рубашке. В ходе эксперимента измеряют повышение температуры водяной рубашки, которое обычно не превышает одного-двух градусов. По повышению температуры вычисляют количество выделившегося тепла. Поскольку процесс идет при постоянном объеме, выделяющееся тепло равно изменению внутренней энергии системы.
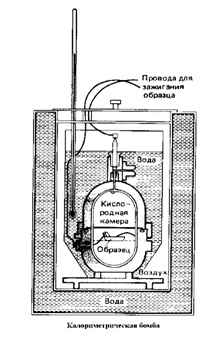
Рис.2. Калориметр – прибор для определения тепловых эффектов реакций
Современные калориметры настолько чувствительны, что позволяют использовать очень маленькие образцы горючих веществ. Теплотворная способность некоторых важных топлив приведена в таблице 1.
Таблица 1. Теплотворная способность некоторых видов топлива
| Название топлива | Теплотворная способность, кДж/г |
| Антрацит | 32,6 |
| Бурый уголь | 27,2 |
| Метан (осн. комп. Прир. газа) | 55,6 |
| Этанол | 30,4 |
| Водород | 142,9 |
| Бензин | |
В организме человека жиры и углеводы окисляются до углекислого газа и воды. Калорийность содержащих эти питательные вещества продуктов питания также может быть определена путем сжигания их в калориметрической бомбе. Более сложными методами определяется калорийность белков, так как при окислении в организме белки образуют не азот, который получается при их сгорании, а мочевину.
Таблица 2. Калорийность основных компонентов пищи и некоторых продуктов питания
| Компонент пищи, продукт | Калорийность, кДж/г |
| Углеводы | |
| Белки | |
| Жиры | |
| Сливочное масло | 30,41 |
| Сахар | 16,80 |
| Мясо говяжье | 11,07 |
| Картофель | 3,69 |
| Рыба | 3,22 |
Количество энергии, которое необходимо человеческому организму зависит от характера его деятельности, массы его тела, возраста и пола. У мужчин эта величина составляет от 9200 до 12100 кДж в сутки, у женщин от 6700до 8800 кДж.
Иногда калорийность продуктов питания приводится в устаревших единицах –калориях или килокалориях (больших калориях). 1 ккал = 4,184 кДж
Химическая кинетика
Скорость химических реакцийи факторы ее определяющие. Обратимые и необратимые химические процессы. Колебательные реакции.
Химической кинетикой называют учение о скорости химических реакций и зависимости ее от различных условий — природы и концентрации реагирующих веществ, температуры, присутствия катализаторов и других факторов.
Различают гомогенные реакции (протекающие в гомогенных системах) и гетерогенные реакции (протекающие в гетерогенных системах). Гомогенные системы состоят только из одной фазы, а гетерогенные — из нескольких фаз.
Фазой называют группу однородных частей системы, обладающих одинаковым химическим составом и одинаковыми свойствами, но отграниченных от остальных частей системы поверхностью раздела.
Примером гомогенной реакции служит взаимодействие растворов серной кислоты и гидроксида натрия, образующих при сливании одну фазу (жидкую).
| 2 NaOH + H2SO4 → Na2SO4 + 2 H2O |
Растворение цинка в соляной кислоте представляет собой гетерогенную реакцию, так как протекает в двухфазной системе, в которой одна фаза — твердая (цинк), а другая — жидкая (кислота).
Zn + 2 HCl → ZnCl2 + H2↑
Гомогенные реакции протекают во всем объеме системы, гетерогенные —только на поверхности раздела фаз, где соприкасаются друг с другом реагирующие вещества.
Скоростью гомогенной реакции по веществу B называется величина изменения конценцентрации этого вещества в единицу времени. При возрастании концентрации вещества B:
v(B) = dC(B)/dt,
при уменьшении концентрации вещества B:
v(B) = - dC(B)/dt
В общем случае:
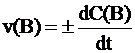
Средней скоростью реакции называют отношение изменения концентрации вещества B к интервалу времени, за который это изменения произошло:
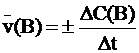
Размерность скорости:
[v(B) = моль/л · с ]
