Модуль 4. строение атома и химическая связь. окислительно-восстановительные реакции
Строение атома и периодический закон
1. Элементарные частицы, их заряды. Атомное ядро. Массовые числа. Изотопы, изобары.
2. Двойственная природа электрона. Квантово-мехнические представления об электроне.
3. Квантовые числа.
4. Строение электронных облочек. Последовательность заполнения электронных слоев. (правило Клечковского, Приицп Паули, Правило Хунда).
5. Электронные формулы элементов.
6. периодический закон и периодическая система химических элементов Д.И. Менделеева.
7. Объяснение свойств элементов с точки зрения строения атома.
В Периодической системе Д. И. Менделеева (табл. П.4) представлены все известные элементы. Она состоит из семи периодов (1-3 - малые, 4-7 - большие), 8 групп. Каждая группа разделена на главную и побочную подгруппы. Главная подгруппа содержит элементы малых и больших периодов, а побочная – только больших.
Пример 1. Укажите в Периодической системе Д.И. Менделеева положение (номер периода, номер группы, главная или побочная подгруппа) атома элемента с зарядом ядра 85.
Решение.Элемент (85At) находится в 6-м периоде, 7-й группе, главной подгруппе.
Атомы элементов состоят из положительно заряженного ядра (протонов и нейтронов) и электронов. Количество электронов равно порядковому номеру элемента. Состояние электрона в атоме характеризуется квантовыми числами n,l, ml и ms, которые называются соответственно главное, орбитальное, магнитное и спиновое.
Порядок заполнения орбиталей электронами определяется следующими правилами В. Клечковского:
· заполнение происходит в порядке увеличения суммы (n + l);
· при одинаковых значениях этой суммы в первую очередь заполняется подуровень с меньшим значением главного квантового числа n.
Последовательность заполнения электронами энергетических уровней и подуровней в многоэлектронных атомах имеет вид
1s <2s <2p <3s <3p <4s <3d <4p <5s <4d <5p <6s <5d 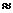 4f <6p <7s <6d
4f <6p <7s <6d 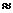 5f <7p.
5f <7p.
Пример 2. Используя правила Клечковского, рассчитайте, какой подуровень раньше заполняется электронами 4р или 5s.
Решение. Для 4р-подуровня Sn + l = 4 + 1 = 5; для 5s-подуровня Sn + l = 5 + 0 = 5. Так как сумма одинакова, то в первую очередь заполняется подуровень с меньшим значением n, т. е. 4р.
Пример 3.По распределению валентных электронов -3d54s2 определите, какой это элемент, укажите его символ и напишите полную электронную формулу.
Решение.Значению главного квантового числа последнего энергетического уровня соответствует номер периода, следовательно, элемент находится в 4-м периоде. Сумма валентных электронов показывает номергруппы, в которой находится элемент, в данном случае номер группы 7. Так как валентные электроны находятся на d-подуровне, то это элемент побочной подгруппы: 25Mn 1s22s22p63s23p64s23d5.
Пример 4. Напишите полную электронную формулу атома элемента с зарядом ядра 22.
Решение. 22Ti 1s22s22p63s23p64s23d2.
Пример 5. Напишите полные электронные формулы ионов Fq, Sn2+.
Решение. При образовании отрицательно заряженного иона нейтральный атом элемента принимает электроны: F0 + 1ē = Fq;электронная формула иона9Fq1s22s22p6. Положительно заряженный ион получается, когда нейтральный атом элемента отдает электроны: Sn0 - 2ē = Sn2+; электронная формула иона 50Sn2+ 1s22s22p63s23p6 4s23d104p65s24d105p0.
Упражнения
1. Не пользуясь периодической системой, определите, в какой группе и в каком периоде находится элемент с порядковым номером 49.
2. Покажите распределение электронов по энергетическим уровням в атомах азота, титана, галлия, цезия, вольфрама.
3. Напишите электронные формулы элементов с порядковыми номерами 13, 27 и 56. К каким типам элементов с точки зрения строения атома они относятся?
4. Напишите электронные формулы ионов: Na+, Cl-, Fe2+, S2-, Bi3+.
5. Элементы какой группы периодической системы имеют электронное строение внешнего энергетического уровня s2p5
