Электролиз раствора сульфата меди
Теоретические основы. При пропускании электрического тока через растворы или расплавы электролитов на электродах происходят окислительно-восстановительные процессы, называемые электролизом.
В растворах или расплавах электролита, например МХ, происходит процесс электролитической диссоциации:
МХ  Ма+ + Ха
Ма+ + Ха 
Образующиеся ионы под действием сил электростатического притяжения перемещаются к противоположно заряженным электродам, где участвуют в окислительно-восстановительных процессах. В них могут также участвовать ионы водорода (в кислой среде) и молекулы воды.
Процессы, проходящие на катоде (отрицательно заряженном электроде). Этот электрод имеет избыток электронов, на нем происходят процессы восстановления:
а). Восстановление катиона металла (или катиона водорода): Ма+ + а е  М0
М0
2Н+ + 2е  Н2
Н2 
б). Восстановление молекул воды:
2Н2О + 2е  Н2
Н2  + 2ОН
+ 2ОН 
Если металл в ряду напряжений стоит после олова (Sn), в кислой среде - после водорода, то возможен только процесс восстановления металла (водорода) (а).
Если металл в ряду напряжений стоит до алюминия (Аl), то возможен только процесс восстановления молекул воды (б).
Если металл в ряду напряжений стоит между алюминием и оловом, то оба процесса идут одновременно.
Если электролизу подвергается раствор смеси солей (и кислот), то первыми на катоде будут восстанавливаться менее активные ионы (стоящие правее в ряду напряжений).
Процессы, проходящие на аноде (положительно заряженном электроде). На этом электроде существует недостаток электронов, поэтому идут процессы окисления, в которых могут участвовать ионы соли, молекулы воды и непосредственно анод.
а). Если анод растворимый (металлический, кроме анодов, изготовленных из золота и платины), то идет процесс окисления (растворения) анода: 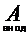 - m e
- m e  Am+
Am+
б). Если анод нерастворимый (неметаллический, в частности угольный, а также золотой или платиновый), а анион представляет собой остаток бескислородной кислоты (Сl  ; Br
; Br  ; I
; I  ; S2
; S2  ), кроме аниона F
), кроме аниона F  , то идет процесс окисления аниона, например, 2Сl
, то идет процесс окисления аниона, например, 2Сl  + 2е
+ 2е  Cl2
Cl2 
в). Если анод нерастворимый (неметаллический, в частности угольный, а также золотой или платиновый), а анион имеет сложный состав (SO42  ; NO3
; NO3  ) или F
) или F  , то идет процесс окисления молекул воды (в щелочной среде - гидроксильных групп ОН
, то идет процесс окисления молекул воды (в щелочной среде - гидроксильных групп ОН  ): 2Н2О - 4е
): 2Н2О - 4е  О2
О2  + 4Н+
+ 4Н+
4ОН  - 4е
- 4е  О2
О2  + 2Н2О
+ 2Н2О
Пример. Электролиз раствора нитрата калия на медном аноде.
Диссоциация раствора нитрата калия: KNO3  K++NO3
K++NO3 
Катод: K+; H2O.
Процесс, происходящий на катоде: 2Н2О+2е  Н2
Н2  +2ОН
+2ОН 
Анод: NO3  , H2O, анод медный - растворимый.
, H2O, анод медный - растворимый.
Процесс, происходящий на аноде: 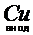 - 2e
- 2e  Cu2+
Cu2+
В общем виде, уравнивая число электронов, участвующих в процессах окисления и восстановления, процесс электролиза нитрата калия на медном аноде можно записать в следующем виде:
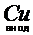 +2Н2О
+2Н2О 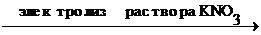 H2
H2  +Cu(OH)2
+Cu(OH)2
Количественно электролиз описывается законами Фарадея: 1. Масса выделяющегося на электроде вещества пропорциональна количеству электричества, протекающего через раствор: m = kIt = kQ, где k- коэффициент пропорциональности, I- сила тока, протекающего через раствор, t- время электролиза (сек), Q - количество электричества (Q=It).
2. Для выделения на электроде 1 эквивалента любого вещества необходимо затратить одно и то же количество электричества, равное числу Фарадея: F = 96500 Кл 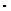 моль
моль  1. Обобщая оба закона Фарадея, можно записать: m =
1. Обобщая оба закона Фарадея, можно записать: m = 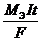
Реально выделяющееся при электролизе количество вещества меньше, чем рассчитанное теоретически по вышеприведенной формуле. Выход по току: h = 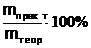
Цель работы. Изучить электролиз раствора сульфата меди на медном аноде, рассчитать выход по току.
Порядок работы.
1. Зачистите наждачной бумагой медный электрод и измерьте его массу с точностью до 0,01 г.
2. Присоедините медные электроды к источнику постоянного тока (электрод с известной массой - к катоду), опустите электроды в стакан с раствором сульфата меди.
3. Включите секундомер одновременно с источником тока. Установите и поддерживайте силу тока 2,5 А в течение всего времени электролиза (время электролиза указывает преподаватель).
4. По окончании электролиза отключите источник тока, отсоедините катод, промойте его в ацетоне и высушите в токе теплого воздуха, держа в 30-40 см над газовой горелкой.
5. Охладите катод до комнатной температуры и определите его массу после электролиза.
6. Рассчитайте теоретический выход меди и выход по току.
Форма лабораторного отчета.
1. Название лабораторной работы.
2. Краткое описание, цель работы.
3. Электрохимические процессы, происходящие при электролизе раствора сульфата меди на медном аноде.
4. Экспериментальные данные:
а) сила тока I = ......
б) время электролиза t = ....
в) масса катода до электролиза m1 = ....
г) масса катода после электролиза m2 = ....
5. Расчеты:
а) практический (экспериментальный) выход меди mпракт.= ....
б) теоретический выход меди (рассчитывается по формуле закона Фарадея) mтеор. = ....
в) выход по току h = ....
Типовые задачи.
1. Написать уравнения реакций, протекающих при электролизе расплавов следующих электролитов с инертным анодом: а) CuCl2; б) K2S; в) NaOH; г) AlF3.
2. Написать уравнения реакций, протекающих при электролизе растворов следующих электролитов: а) CuSO4, анод инертный; б) NiCl2, анод Au; в) Na2SO4, анод C; г) AgNO3, анод Cu; д) KCl, анод Al.
3. В каком порядке будет проходить восстановление ионов на катоде при электролизе водного раствора, содержащего смесь нитратов серебра, никеля и натрия ?
4. Какое количество электричества потребуется для выделения из раствора: а) 2 г водорода; б) 2,25 л кислорода (н.у.) ?
5. Какой объем кислорода (условия нормальные) выделится при пропускании тока силой 6 А в течение 30 мин. через водный раствор гидроксида калия ?
6. Сколько времени потребуется для полного разложения 2 моль воды током силой 2 А ?
7. При электролизе водного раствора NaOH на аноде выделилось 2,8 л кислорода (н.у.). Какой объем водорода, измеренный в тех же условиях, выделится на катоде ?
8. За 10 мин. Из раствора хлорида платины ток силой 5 А выделил 1,517 г металла. Вычислить молярную массу эквивалента платины и установить состав соли.
9. При прохождении через раствор соли трехвалентного металла тока силой 1,5 А в течение 30 мин. на катоде выделилось 1,071 г металла. Вычислить молярную массу металла.
10. При электролизе раствора нитрата серебра током силой 7,0 А в течение 8,5 мин. масса катода увеличилась на 2,59 г. Найти выход по току.
11. При электролизе раствора сульфата меди током силой 87,0 А в течение 68,5 мин. масса катода увеличилась на 0,72 г. Найти выход по току.
Лабораторная работа 15
Коллоидные растворы
Теоретические основы. Системы, в которых одна составная часть равномерно распределена в объеме другой, называются дисперсными. Составная часть, которая распределена в мелкораздробленном состоянии, называется дисперсной фазой. Часть системы, в которой распределена дисперсная фаза, называется дисперсионной средой.
В зависимости от размера частиц дисперсной фазы системы делятся на крупнодисперсные, коллоидные и истинные растворы. В крупнодисперсных системах диаметр частиц дисперсной фазы превышает 10-5 см, в коллоидных (золях) - диаметр может колебаться от 10-5 см до 10-7 см, тогда как в истинных растворах диаметр частиц не превышает 10-7 см.
Как дисперсная фаза, так и дисперсионная cреда могут иметь различные агрегатные состояния - находиться в твердом (Т), жидком (Ж) или газообразном (Г) состояниях. В зависимости от агрегатных состояний дисперсной фазы и дисперсионной cреды, такие системы имеют различные названия.
| Дисп.фаза Дисп.среда | газ (Г) | жидкость (Ж) | твердое состояние (Т) |
| газ (Г) | - | аэрозоли туманы | дымы пыли |
| жидкость (Ж) | пены | эмульсии | суспензии взвеси |
| твердое состояние (Т) | пенопласты | гели | литозоли |
Существует два метода получения веществ в коллоидном состоянии: дисперсионный (от “dispergere” - рассеивать) - состоит в раздроблении крупных частиц до размера коллоидных, и конденсационный (от “condensare” - сгущать) - заключается в объединении многих молекул или атомов в коллоидную частицу. Диспергирование осуществляется механическим путем, а конденсирование - с помощью химических реакций. При образовании коллоидных частиц большую роль играет явление адсорбции.
Адсорбцией называется концентрирование газообразных или растворенных веществ на поверхности твердого или жидкого тела. Адсорбция характерна для гетерогенных реакций. Способность поверхности адсорбировать вещества объясняется особым состоянием молекул, находящихся в поверхностном слое. За счет сил притяжения частицы дисперсной фазы окружаются ионами дисперсионной среды (растворителя) и приобретают одноименный заряд, мешающий коагуляции коллоида - объединению частиц в более крупные.
Коллоидные растворы обладают специфическими электрическими и оптическими свойствами: при пропускании постоянного электрического тока через коллоидную систему (электрофорез) все коллоидные частицы движутся к одному электроду, а противоионы - к другому. Коллоидные растворы рассеивают свет и часто опалесцируют при боковом освещении.
Цель работы. Познакомиться с различными типами коллоидных растворов, способами их получения и их оптическими свойствами.
Порядок работы.
Опыт 1. Получение коллоидного раствора серы.
Налейте в пробирку 2-3 мл 2N раствора тиосульфататa натрия и добавьте 2 мл 2N раствора серной кислоты. Наблюдайте образование коллоидного раствора. Посмотрите сквозь раствор на свет. Опишите наблюдаемые с течением времени изменения в растворе.
Опыт 2. Получение золя гидрооксида железа (III).
в химическом стакане нагрейте до кипения 50 мл воды. Затем в кипящую воду прилейте 1-2 мл 2%-ого раствора FeCl3. Наблюдайте интенсивное окрашивание. Высокая температура при которой идет реакция смещает равновесие реакции гидролиза вправо. Охладите стакан и наблюдайте изменения в растворе. Опишите наблюдаемые изменения.
Опыт 3. Получение геля кремниевой кислоты.
Налейте в пробирку 2 мл концентрированного раствора силиката натрия Na2SiO3 и прибавьте к нему 1 мл 4Н раствора соляной кислоты и хорошо перемешайте стеклянной палочкой. Через некоторое время наблюдается выделение кремниевой кислоты в виде геля.
Опыт 4. Получение эмульсии масла.
Налейте в пробирку 2-3 мл дистиллированной воды и добавьте несколько капель растительного масла. Закрыв пробирку пробкой, хорошо встряхните. Получается неустойчивая эмульсия, которая быстро расслаивается.
Добавьте в вашу пробирку несколько капель 1%-ого раствора мыла и еще раз взболтайте ее. Объясните получение устойчивой эмульсии во втором случае.
Опыт 5. Коагуляция золей.
Налейте в пробирку 3-4 мл хлорида сурьмы и добавьте немного раствора сульфида натрия. Наблюдайте изменение цвета раствора, определите рН cреды, зная что часть молекул сульфида натрия подвергается гидролизу и в адсорбционном слое коллоидных частиц находятся ионы HS  .
.
Добавьте к полученному золю 2 мл 2N раствора сульфата калия. Объясните коагулирующее действие K2SO4.
Форма лабораторного отчета.
1. Название лабораторной работы.
2. Краткое описание, цель работы.
3. В каждом опыте напишите наблюдения и уравнения реакций в молекулярной и ионной формах. Где это возможно, нарисуйте структуру мицеллы - коллоидной частицы вместе адсорбированными ионами и ближайшими противоионами.
Контрольные вопросы.
1. Что такое дисперсные системы?
2. Напишите, каким способом получен каждый из коллоидных растворов в данной лабораторной работе.
3. Приведите по два примера каждого из встречающихся в жизни типов коллоидных систем: Ж/Г, Г/Ж, Т/Ж, Ж/Ж и Т/Ж. Назовите их.
Лабораторная работа 16
Cвойства полимеров
Теоретические основы. Уже несколько десятилетий в промышленности и строительстве используются синтетические полимерные материалы. Они совмещают в себе совокупность ценных технических свойств, которых может и не быть у природных материалов. Синтетические материалы также могут являться более доступными заменителями природных. Среди полимеров различают пластмассы, синтетические волокна, синтетические каучуки. Полимеры состоят из соединенных друг с другом много раз повторяющихся структурных единиц (мономеров). Их строение можно представить на примере молекулы полиэтилена: (-СН2-СН2-)m, где m- число структурных единиц мономера в молекуле полимера (степень полимеризации). Это число зависит от условий процесса получения полимера и влияет на свойства полимера.
Полиэтилен применяют для производства санитарно-технических труб, для выработки пленок различного назначения и для других промышленных нужд.
Поливинилхлорид, получаемый полимеризацией хлорэтена - один из распространенных полимеров, применяется в технологии строительных пластмасс - для изготовления линолеума, вентиляционных коробов, теплоизоляторов, которые не подвергаются коррозии. Поливинилхлорид размягчается при 50-600С, при нагревании выделяет хлороводород, который легко можно определить по образованию белого дыма (хлорида аммония), если поднести к отверстию пробирки палочку, смоченную раствором аммиака. Разбавленные кислоты и щелочи не оказывают на поливинилхлорид заметного действия, тогда как в концентрированных кислотах он сжимается и чернеет.
Полиметилакрилатиз всех пластмасс наиболее прозрачен. Он горит голубым пламенем без копоти с потрескиванием, распространяя эфирный запах. В органических растворителях, например в дихлорэтане, он набухает, а затем растворяется.
Полистиролбывает прозрачным и непрозрачным. Он хрупок и при постукивании звенит. Горит с обильным выделением копоти, распространяя резкий своеобразный запах.
Фенопластыокрашены в темные цвета, они неплавки и нерастворимы ни в одном растворителе. Горят в резким запахом фенола, который может быть обнаружен химическим путем.
Капрон плавиться при температуре 2160 С - с трудом загорается голубоватым пламенем и быстро гаснет. При нагревании разлагается с выделением аммиака. Растворим в концентрированных кислотах.
Все вышеперечисленные полимеры можно рассматривать как вид пластмасс, состоящих из одной смолы. Большинство же пластмасс кроме смолы содержат еще и другие составные части:
- наполнители: древесная мука, асбест, бумага, ткань и.т.д.
- пластификаторы: сложные эфиры органических кислот
-смазывающие масла и красители, обуславливающие определенные физические свойства, плотность, цвет.
Пенопластыполучают путем вдувания под давлением газа в размягченную смолу с последующим охлаждением пены. Пенопласты- легкий строительный и теплоизоляционный материал.
Цель работы. Изучение физических и химических свойств полимеров. Распознавание некоторых полимеров химическим путем.
Порядок работы.
Опыт 1. Свойства полиэтилена
1. Возьмите три пробирки, положите в каждую небольшой кусочек полиэтилена. В первую пробирку налейте 2 мл воды, во вторую - 2 мл ацетона, в третью - 2 мл толуола. Что происходит?
2. Возьмите кусочек полиэтилена тигельными щипцами и внесите в стакан с кипящей водой. Опишите наблюдения.
3. Тигельными щипцами внесите кусочек полиэтилена в пламя горелки. Обратите внимание на цвет пламени и запах.
Опыт 2. Распознавание поливинилхлорида
1. Нагрейте осторожно в пробирке кусочек поливинилхлорида. После начала разложения поднесите к пробирке палочку, смоченную раствором аммиака. Опишите наблюдения. Проверьте лакмусовой бумажкой кислотный характер летучих продуктов разложения.
2. Сильно нагрейте медную проволоку в пламени горелки, затем прижмите ее к образцу поливинилхлорида и снова внесите в пламя. Наблюдаемая зеленая окраска пламени обусловлена образованием на поверхности проволоки хлорида меди. Такая же реакция характерна для всех полимеров, содержащих хлор.
Опыт 3. Свойства капрона
1. Тигельными щипцами внесите кусочек капрона в пламя газовой горелки. Опишите наблюдения, обратите внимание на цвет пламени и запах.
2. Возьмите четыре пробирки, положите в каждую по кусочку капрона. В первую пробирку добавьте 2 мл 2N раствора азотной кислоты, во вторую - 2 мл 2N раствора соляной кислоты, в третью - 2 мл 2N раствора серной кислоты, а в четвертую 2 мл раствора щелочи. Опишите, что происходит в каждой пробирке.
3. Возьмите три пробирки, положите в каждую по кусочку капрона. В первую пробирку налейте 2 мл воды, во вторую - 2 мл ацетона, в третью - 2 мл толуола. Опишите наблюдения.
4. Внесите кусочек капрона в стакан с кипящей водой. Опишите наблюдения.
Опыт 4. Свойства органического стекла
(полиметакрилата)
1. Возьмите кусочек органического стекла тигельными щипцами и внесите в стакан с кипящей водой. Опишите наблюдения.
2. Тигельными щипцами внесите кусочек полиметакрилата в пламя горелки. Обратите внимание на цвет пламени и запах.
3. Возьмите три пробирки, положите в каждую по кусочку органического. стекла. В первую пробирку налейте 2 мл воды, во вторую - 2 мл ацетона, в третью - 2 мл толуола. Опишите наблюдения.
4. Возьмите четыре пробирки, положите в каждую по кусочку органического. стекла. В первую пробирку добавьте 2 мл 2N раствора азотной кислоты, во вторую - 2 мл 2N раствора соляной кислоты, в третью - 2 мл 2N раствора серной кислоты, в четвертую - 2мл раствора щелочи. Опишите наблюдения, опишите, в каких случаях происходит растворение полимера.
Опыт 5. Доказательство присутствия серы
В полимерном материале
1. Поместите в пробирку несколько кусочков резины и нагрейте пробирку на открытом огне (Опыт проводите под тягой!) . Когда разложение резины станет заметным, поднесите к пробирке фильтровальную бумагу, смоченную раствором соли свинца. Образующийся на бумаге сульфид свинца указывает на наличие серы в полимере.
Форма лабораторного отчета.
1. Название лабораторной работы.
2. Краткое описание, цель работы.
3. Для каждого опыта опишите наблюдения и выводы. Напишите, где возможно, уравнения химических реакций.
Контрольные вопросы.
1. Что такое полимеры? мономеры? макромолекулы?
2. Опишите свойства пластмасс, используемых в лабораторной работе (плотность, механическая прочность, термостойкость, химическая стойкость, электрические свойства).
3. Какими, по вашему мнению, общими свойствами должны обладать полимеры, используемые для изготовления синтетических волокон?
