Кафедра химии и биотехнологии
Кафедра химии и биотехнологии
ХИМИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ
Методические указания к лабораторным работам для студентов
Очной формы обучения по специальности 070100 – «Биотехнология»
Пермь 2006
Составитель Л.В. Аникина
УДК 547.9
Химия биологически активных веществ: метод. указания к лаборат. работам / сост. Л.В. Аникина; Перм. гос. техн. ун-т. – Пермь, 2006. – 32 с.
Дан порядок выполнения лабораторных работ по программе курса «Химия биологически активных веществ».
Предназначены для студентов очной формы обучения по направлению 550800 – «Химическая технология и биотехнология», специальность 070100 «Биотехнология».
Рецензент: канд. хим. наук В.А.Глушков
© Пермский государственный
технический университет, 2006
«Химия биологически активных веществ» является частью общего курса «Органическая химия». В течение данного курса студенты занимаются изучением элементов биоорганической химии – структурой и пространственной организацией белков, нуклеиновых кислот, углеводов, липидов, низкомолекулярных биорегуляторов.
Лабораторные работы проводятся с целью приобретения навыков и умений выделения биомолекул из биологического материала и исследования их химической структуры и химических свойств с использованием необходимых реактивов и оборудования. Проведение лабораторных работ по химии БАВ позволяет подтвердить теоретические положения и выводы по отдельным вопросам биоорганической химии и тем самым закрепить теоретические знания о строении, пространственной структуре, биологических функциях и основах функционирования белков, нуклеиновых кислот, углеводов, липидов, низкомолекулярных регуляторных молекул и продуктов жизнедеятельности клеток.
Лабораторные работы оформляются каждым студентом согласно следующему плану:
1. Дата.
2. Название лабораторной работы.
3. Цель и значение работы.
4. Принцип выделения, идентификации и количественного определения биомолекул, формулы и химизм реакций.
5. Техника выполнения работы.
6. Наблюдаемые явления и расчеты.
7. Выводы по работе.
В конце каждой работы даются контрольные вопросы, которые помогут при подготовке лабораторной работы к защите.
Лабораторная работа №1
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ УГЛЕВОДОВ В ЯБЛОКЕ
Цель работы – закрепить знания по теме «Углеводы» и овладеть методами количественного определения содержания углеводов в растительном сырье.
В различных сортах яблок содержится от 600 до 14800 мг% углеводов с преобладанием отдельных моносахаридов, а также сахарозы.
Исследуемый материал: яблоки нескольких сортов.
Реактивы:
1. 0,1 н раствор йода.
2. 0,1 н раствор натрия гидроксида.
3. 10% раствор серной кислоты.
4. 0,1 н раствор натрия тиосульфата.
5. 1% раствор крахмала.
6. 10% раствор соляной кислоты.
7. Сода.
Оборудование:
1. Плоскодонные колбы на 50 мл.
2. Водяная баня с термометром.
3. Воронки.
4. Фильтры бумажные.
5. Мерные колбы на 100 мл.
6. Пипетка на 5 мл.
7. Индикаторная бумага.
8. Мерные колбы на 50 мл.
Ход работы. Берут навеску 5 г одного из сортов яблок, прибавляют 50 мл дистиллированной воды и экстрагируют на водяной бане при температуре 70оС в течение 30 минут. Температуру бани не доводят до 100оС, чтобы избежать гидролиза сахарозы, который может идти под влиянием имеющихся в яблоках кислот. По истечении времени нагревания вытяжку отфильтровывают через складчатый фильтр в мерную колбу на 100 мл. Остаток на фильтре несколько раз промывают горячей водой. Охлажденную до комнатной температуры вытяжку с промывными водами доводят водой до метки. Отбирают пипеткой 5 мл вытяжки и определяют в ней содержание глюкозы по Вильштеттеру. Метод определения основан на свойствах окисления альдегидной группы глюкозы йодом до карбоксильной группы в присутствии фруктозы и сахарозы, которые остаются неизменными.
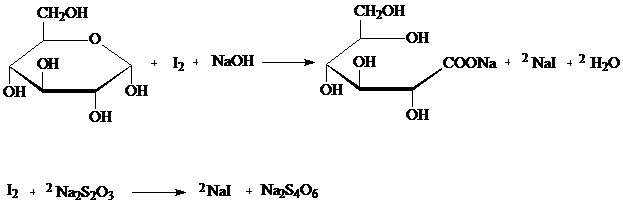
Для определения глюкозы по Вильштеттеру к 5 мл исследуемого раствора прибавляют 7 мл 0,1 н раствора йода. Через 2 минуты при энергичном перемешивании медленно добавляют 10 мл 0,1 н раствора натрия гидроксида и оставляют стоять на 20 минут. После этого раствор подкисляют 10% раствором серной кислоты до кислой рН и остаток йода титруют 0,1 н раствором натрия тиосульфата в присутствии индикатора – раствора крахмала.
Далее 25 мл вытяжки из яблок помещают в коническую колбу, прибавляют 2 мл 10% соляной кислоты и смесь выдерживают на кипящей водяной бане в течение 30 мин, затем раствор охлаждают, доводят до нейтральной рН с помощью соды, переливают в мерную колбу на 50 мл и доводят водой до метки. Далее снова определяют глюкозу по методу Вильштеттера. В этом случае будет определена свободная глюкоза + глюкоза, образовавшаяся при расщеплении сахарозы.
Указания к составлению отчета. Содержание глюкозы рассчитывают по формуле
Q=Tглюкозы × (Vйод – Vтиосульфат),
где Тглюкозы = 9 мг/мл.
Результат определения содержания глюкозы и сахарозы необходимо выразить в г/кг яблок (количество г глюкозы или сахарозы в 1 кг яблок), или в мг% (количество мг глюкозы или сахарозы в 100 г яблока). Молекулярная масса глюкозы – 180, сахарозы – 342. Написать уравнение реакции гидролиза сахарозы.
Контрольные вопросы:
1. Какие свойства глюкозы положены в основу метода ее определения?
2. Почему для определения сахарозы необходим ее гидролиз?
3. Какие органические соединения, кроме углеводов, находятся в яблоке?
4. Как вы полагаете, какое яблоко будет слаще на вкус, в котором больше глюкозы или сахарозы?
Лабораторная работа №2
РАЗДЕЛЕНИЕ ЛИПИДОВ СЫВОРОТКИ КРОВИ МЕТОДОМ ТОНКОСЛОЙНОЙ ХРОМАТОГРАФИИ
Цель работы – закрепить знания по теме «Липиды» и определить методом тонкослойной хроматографии отдельные фракции липидов сыворотки или плазмы крови, характеризующие липидный обмен организма и функцию печени.
Метод основан на различной скорости перемещения липидных фракций сыворотки крови (фосфолипиды, свободные жирные кислоты, холестерин, триацилглицериды) в тонком слое адсорбента при движении через него органического растворителя. Скорость разделения фракций зависит от их относительной полярности, и для их обнаружения полученные хроматограммы обрабатывают парами йода.
Исследуемый материал: сыворотка или плазма крови.
Реактивы:
1. Этанол – диэтиловый эфир (3:1).
2. Хлороформ.
3. Растворитель для хроматографии: н-гексан – диэтиловый эфир – уксусная кислота (73:25:2).
4. Йод металлический.
Оборудование:
1. Пластинки хроматографические Силуфол УФ254.
2. Камера для хроматографии.
3. Водяная баня.
4. Мерная колба на 25 мл.
5. Выпарительная чашка.
6. Пипетка на 10 мкл.
7. Камера для проявления хроматограмм.
8. Хроматоскоп.
Ход работы. В мерной колбе на 25 мл смешивают 1 мл исследуемой сыворотки крови с 10 мл приготовленной спиртово-эфирной смеси. Колбу с содержимым помещают на 30 с в кипящую водяную баню, охлаждают под струей холодной воды и доводят объем спиртово-эфирной смесью до 25 мл. Полученный липидный экстракт отфильтровывают через обезжиренный бумажный фильтр в выпарительную чашку, выпаривают досуха в кипящей водяной бане, а осадок растворяют в 0,2 мл хлороформа.
В хроматографическую камеру наливают 3 мл растворителя для хроматографии. На хроматографическую пластинку, отступая 1 см от края, пипеткой наносят 10 мкл хлороформного экстракта, помещают пластинку в камеру этим концом вниз, погрузив его на 3-5 мм в растворитель. Камеру закрывают крышкой для поддержания равномерной концентрации паров. Хроматографию проводят при комнатной температуре до тех пор, пока фронт растворителя не приблизится к верхнему краю, не доходя до него 0,5 см.
Полученную хроматограмму извлекают из камеры, высушивают на воздухе и вносят для проявления в камеру, на дно которой предварительно насыпают кристаллы металлического йода. Сосуд закрывают и подогревают на водяной бане при 60оС. Возгоняющийся йод вступает в реакцию с липидными фракциями.
Через 1 мин хроматограмму извлекают и просматривают в ультрафиолетовом свете на хроматоскопе. Фракции липидов обнаруживают в виде коричневых пятен. Ближе к линии старта расположены фосфолипиды, затем неидентифицированные соединения, холестерин, моноацилглицериды, диацилглицериды, свободные жирные кислоты, триацилглицериды и эфиры холестерина.
Указания к составлению отчета. Зарисовать полученную хроматограмму, указав в ней соответствующие липидные фракции сыворотки крови. Написать формулы представителей каждой липидной фракции в порядке убывания их относительной полярности.
Контрольные вопросы:
1. Повторите классификацию липидов.
2. Вспомните строение холестерина и его эфиров.
3. От чего зависит скорость перемещения липидов в слое сорбента при использовании органического растворителя?
4. Как возможно количественно определить липидные компоненты после разделения их методом ТСХ?
Лабораторная работа №3
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА БЕЛКИ И АМИНОКИСЛОТЫ
Цель работы – закрепить знания по аминокислотному составу белков и приобрести навыки проведения цветных реакций на белки и отдельные аминокислоты.
При взаимодействии белка с отдельными химическими веществами возникают окрашенные продукты реакции. Образование их обусловлено присутствием в молекуле белка той или иной аминокислоты, имеющей в боковом радикале определенную химическую группировку. Некоторые реакции присущи не только белкам, но и другим веществам, содержащим те же химические группировки, поэтому для установления наличия белка недостаточно проведения одной какой-нибудь реакции.
Значение цветных реакций состоит в том, что они дают возможность установить белковую природу вещества и доказать присутствие некоторых аминокислот в различных природных белках. На основании цветных реакций разработаны методы количественного определения белков и аминокислот.
Исследуемый материал: сыворотка или плазма крови, 1% раствор яичного белка (белок одного куриного яйца растворяют в 20-кратном объеме дистиллированной воды, фильтруют через марлю).
Реактивы:
1. 10% раствор NaOH.
2. 1% раствор CuSO4.
3. 0,1% водный раствор нингидрина.
4. Концентрированная азотная кислота.
5. Ледяная уксусная кислота.
6. Концентрированная серная кислота.
7. 5% раствор ацетата свинца.
Оборудование:
1. Штатив с пробирками.
2. Пипетки.
3. Песчаная баня или спиртовка.
Ход работы:
Лабораторная работа №4
ХРОМАТОГРАФИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ АМИНОКИСЛОТ
Цель работы – освоить метод разделения и идентификации аминокислот с помощью радиальной распределительной хроматографии.
Для изучения аминокислотного состава гидролизатов очищенных белков широко применяют распределительную хроматографию на бумаге – простой, доступный и весьма эффективный метод определения аминокислот.
Метод основан на разной скорости передвижения аминокислот по бумаге в зависимости от коэффициента распределения их между неподвижной (водной) и подвижной (органической) фазами растворителя. Органический растворитель, передвигаясь под действием капиллярных сил, одновременно увлекает за собой нанесенные на бумагу аминокислоты, перемещающиеся с различной скоростью. Скорость зависит от химического строения аминокислот, от их способности быстрее растворяться в органическом подвижном растворителе или, наоборот, в менее подвижном – воде. Расположение отдельных аминокислот обнаруживают путем проявления хроматограмм. Для этого высушенную бумагу обрабатывают раствором нингидрина и затем нагревают ее в сушильном шкафу до 100ОС, то есть проводят качественную нингидриновую реакцию на аминокислоты, находящиеся на бумаге. Скорость перемещения аминокислот выражают коэффициентом распределения. Коэффициент распределения Rf для аминокислоты определяется по уравнению: Rf = a/b, где a – расстояние, пройденное аминокислотой от места старта до середины пятна, b – расстояние, пройденное фронтом растворителя от места старта до финиша.
Чем меньше растворимость аминокислот в воде и чем больше растворимость в органическом растворителе, тем быстрее они движутся вслед за фронтом органического растворителя и тем больше величина Rf и, наоборот, чем больше растворимость в воде и меньше в органическом растворителе, тем медленнее аминокислота будет передвигаться и тем меньше Rf. Поскольку отдельные аминокислоты в смеси обладают различной скоростью движения, происходит постепенное их разделение.
Величина Rf, кроме химического строения аминокислот и применяемого растворителя, зависит от сорта хроматографической бумаги, ее плотности и окружающей температуры. Коэффициент распределения Rf является характерной величиной для каждой аминокислоты и постоянен при данных условиях опыта. Сравнивая Rf известных стандартных аминокислот с Rf аминокислот, полученными для исследуемой смеси, можно качественно определить состав смеси. Подвергая пятна аминокислот элюированию (растворению) и колориметрированию, можно качественно определить даже крайне незначительные количества аминокислот (до 0,1 мкг).
Исследуемый материал: стандартные растворы аминокислот для хроматографии (в 10 мл растворяют 60 мг глутаминовой или аспарагиновой кислоты, 50 мг лейцина, 40 мг глицина или аланина, или серина), раствор смеси аминокислот.
Реактивы:
1. Растворитель – смесь н-бутилового спирта, уксусной кислоты и воды в соотношении 15:15:10.
2. 0,1% спиртовый или 0,2% ацетоновый раствор нингидрина.
Оборудование:
1. Хроматографическая бумага.
2. Карандаш.
3. Линейка.
4. Микропипетка или капилляр.
5. Чашка Петри.
6. Сушильный шкаф, нагретый до 100-105оС.
7. Пульверизатор.
Ход работы. Из хроматографической бумаги вырезают квадрат со сторонами 12 см (больше, чем диаметр чашки Петри) и делят карандашом по диагонали на 4 сектора. В центре карандашом делают круг – линию старта. В центре круга делают небольшой вырез. На линию старта в трех секторах микропипеткой наносят капли трех стандартных растворов аминокислот, а в четвертом секторе наносят каплю определяемой смеси аминокислот. Карандашом подписывают, в каком секторе находятся какие аминокислоты и смесь. Квадрат подсушивают на воздухе. В центр квадрата вставляют бумажный фитилек 1,5 см высотой.
На дно чашки Петри аккуратно наливают 10 мл растворителя, бумажный квадрат накладывают на края чашки Петри так, чтобы фитилек касался растворителя. Чашку Петри закрывают крышкой, желательно равной по диаметру, и оставляют при комнатной температуре до тех пор, пока фронт растворителя не дойдет до краев чашки. Затем снимают крышку чашки Петри, отмечают карандашом фронт растворителя во всех четырех секторах и сушат хроматограмму в сушильном шкафу 5-10 минут для фиксации аминокислот и испарения растворителя. Растворитель из чашки Петри сливают в отведенную для этого склянку.
Далее хроматограмму проявляют, осторожно опрыскивая ее в вытяжном шкафу из пульверизатора раствором нингидрина. Снова сушат в шкафу для прохождения нингидриновой реакции и проявления аминокислот-свидетелей в виде отдельных пятен в каждом секторе. Для смеси аминокислот наблюдается несколько окрашенных полос.
Указания к составлению отчета. Нарисуйте или приклейте в тетрадь хроматограмму. Проведите расчеты Rf. На основании значений коэффициента распределения сделайте вывод о качественном составе аминокислот в смеси.
Контрольные вопросы:
1. На чем основано разделение аминокислот в данной работе?
2. Почему для хроматографии используется смесь растворителей?
3. На чем основана нингидриновая реакция, используемая в работе?
4. Что такое коэффициент Rf?
Лабораторная работа №5
РЕАКЦИИ ОСАЖДЕНИЯ БЕЛКОВ
Цель работы. – закрепить знания по теме «Физико-химические свойства белков» и овладеть навыками осаждения белков.
Существует большое количество разнообразных реакций осаждения белков. Как правило, реакции осаждения являются первой стадией процесса выделения, очистки, качественного и количественного определения отдельных белков. В зависимости от применяемого осадителя реакции осаждения могут быть обратимыми и необратимыми. В случае обратимых реакций белки не подвергаются глубоким изменениям и получаемые осадки могут быть вновь растворены в первоначальном растворителе, обычно в воде. Белки при этом сохраняют свои свойства. При необратимых реакциях осажденные белки подвергаются глубоким изменениям (денатурации), утрачивают свои биологические и физико-химические свойства, становятся менее гидрофильными и теряют способность растворяться в воде.
Исследуемый материал: сыворотка крови или 1% раствор яичного белка.
Реактивы:
1. 10% раствор сульфата меди.
2. Концентрированная азотная кислота.
3. 10% раствор трихлоруксусной кислоты.
4. Этиловый спирт или ацетон.
5. Насыщенный раствор хлорида натрия.
Оборудование:
1. Штатив с пробирками.
2. Пипетки.
Ход работы.
1. Осаждение белков солями тяжелых металлов
Метод основан на свойстве ионов тяжелых металлов связываться с функциональными группами боковых радикалов аминокислот в молекуле белка, в результате чего разрушается ее пространственная структура и происходит осаждение денатурированного белка. При добавлении избытка солей тяжелых металлов (кроме AgNO3 и HgCl2) происходит растворение первоначально образующегося осадка из-за абсорбции иона металла и приобретения вследствие этого белковой молекулой положительного заряда.
К 5 каплям исследуемого раствора белка прибавляют осторожно 1 каплю 10% раствора сульфата меди. Образуется бледно-голубой осадок, нерастворимый в воде. К другой такой же порции раствора белка приливают вначале 1 каплю 10% раствора сульфата меди, а затем еще 10 капель и наблюдают растворение осадка в избытке реактива.
Лабораторная работа №6
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ БЕЛКА
Цель работы – освоить метод количественного определения белка в биологическом материале и познакомиться с использованием стандартных тест-систем.
Для количественного определения белков в биологическом материале чаще всего употребляются азотометрия, фотоколориметрия и спектрофотометрия.
Азотометрия основана на определении содержания азота белка после минерализации исследуемого образца. К азотометрии относится классический метод Кьельдаля и его модификации. Эти методы очень трудоемки и не всегда надежны, так как процентное содержание азота в разных белках колеблется от 14 до 19.
Фотоколориметрические методы основаны на цветных реакциях на функциональные группы белков. Среди них наиболее частое применение нашли биуретовая реакция на пептидные группы и реакция Фолина на ароматические радикалы аминокислот. Биуретовый метод является более специфичным, так как ему не мешают примеси – свободные аминокислоты и фенольные соединения.
Спектрофотометрические методы делят на прямые и косвенные. Последние представляют собой более чувствительный и точный вариант фотоколориметрического. После проведения цветной реакции на белки проводят спектрофотометрию окрашенного раствора и по светопоглощению его в монохроматическом свете рассчитывают содержание белка. Прямой метод состоит в измерении светопоглощения раствора белка в УФ-области при 200–220 нм (пептидные группы белка) и при 280 нм (ароматические радикалы аминокислот). Эти методы весьма удобны и не требуют предварительного образования окрашенных комплексов, однако для их применения необходимо специальное оборудование.
Для рутинных исследований в биологических и медицинских лабораториях в основном пользуются стандартизированными наборами реагентов, так как работа с ними значительно сокращает подготовительную часть работы, существенно повышает правильность определения концентраций и упрощает расчетную часть за счет использования стандарта. Применительно к нашей задаче существует набор для определения концентрации общего белка в сыворотке и плазме крови биуретовым методом (Total Protein FL-E – производитель «Витал Диагностикс СПб», использующий стандарт фирмы Sigma).
Метод основан на способности белка образовывать окрашенный комплекс с ионами меди в щелочной среде, интенсивность окраски которого пропорциональна содержанию белка в исследуемом материале.
Исследуемый материал: сыворотка или плазма крови.
Реактивы: набор для определения концентрации общего белка в сыворотке и плазме крови биуретовым методом (Total Protein FL-E «Витал Диагностикс СПб»), в который входит:
1. Концентрат биуретового реактива, содержащий натр едкий 0,5 моль/л; калий-натрий виннокислый 80 ммоль/л; калий йодистый 75 ммоль/л; сульфат меди 30 ммоль/л. Концентрат стабилен в темноте при комнатной температуре. Перед проведением анализа необходимое количество разводят в 5 раз (1 часть концентрата + 4 части дистиллированной воды).
2. Стандарт, содержащий альбумин сывороточный 70 г/л; натрий хлористый 154 ммоль/л. Стабилен не менее года при комнатной температуре.
Оборудование:
1. Фотоэлектроколориметр.
2. Штатив с пробирками.
3. Пипетки на 5 мл и 100 мкл.
Ход работы. Взять три пробирки. В первую пробирку (опыт) поместить 5 мл биуретового реактива и 100 мкл сыворотки или плазмы крови. Во вторую пробирку (стандарт) поместить 5 мл биуретового реактива и 100 мкл стандарта. В третью пробирку (контроль) поместить 5 мл биуретового реактива и 100 мкл дистиллированной воды. Содержимое пробирок перемешивают, выдерживают при комнатной температуре 30 минут.
Содержимое опытной и стандартной пробирки фотометрируют против контроля при длине волны 540 нм в кювете с толщиной поглощающего слоя 1 см не позже чем через час после начала инкубации.
Указания к составлению отчета. Концентрацию общего белка рассчитывают в г/л по формуле
г/л = (Еопыт/Естандарт) × 70,
где Еопыт – экстинкция опыта,
Естандарт – экстинкция стандарта,
70 – концентрация белка в стандарте в г/л.
Контрольные вопросы:
1. Какая реакция лежит в основе метода и на чем она основана?
2. В чем преимущество определения концентрации веществ по стандарту перед определением по калибровочному графику?
Лабораторная работа №7
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА КОМПОНЕНТЫ НУКЛЕИНОВЫХ КИСЛОТ
Цель работы – закрепить теоретические знания по теме «Нуклеиновые кислоты и нуклеопротеиды» и приобрести навыки качественного определения компонентов нуклеиновых кислот, образующихся в результате гидролиза нуклеопротеидов.
Для изучения состава нуклеопротеидов проводят кислотный гидролиз дрожжей в присутствии серной кислоты. При непродолжительном гидролизе нуклеопротеиды распадаются на белок и нуклеиновые кислоты. При продолжительном гидролизе наступает полный распад нуклеопротеидов. С помощью специальных реакций можно открыть в гидролизате составные части нуклеопротеидов. Биуретовой реакцией устанавливают наличие полипептидов. Пуриновые основания обнаруживают по осадку серебряных солей, фосфорную кислоту – по реакции с молибдатом аммония, а пентозу – пробой Троммера.
Исследуемый материал: пекарские дрожжи.
Реактивы:
1. 10% раствор серной кислоты.
2. Аммиак концентрированный.
3. 2% аммиачный раствор нитрата серебра (к 2% раствору нитрата серебра добавляют концентрированный раствор аммиака до растворения осадка).
4. 10% раствор NaOH.
5. 7% раствор CuSO4.
6. 1% раствор CuSO4.
7. Молибдат аммония в азотной кислоте (7,5 г молибдата аммония растворяют в 100 мл воды и добавляют 100 мл 32% раствора азотной кислоты; полное растворение молибдата аммония происходит после добавления азотной кислоты).
8. 1% раствор аскорбиновой кислоты на 1М растворе HCl.
Оборудование:
1. Большая пробирка или круглодонная колба с пробкой, в которую вставлена длинная стеклянная трубка.
2. Песчаная баня.
3. Штатив с пробирками.
4. Пипетки.
5. Индикаторная бумага.
Ход работы. Помещают 1 г пекарских дрожжей в большую пробирку или круглодонную колбу, добавляют 20 мл 10% раствора серной кислоты и 20 мл дистиллированной воды, закрывают пробкой с длинной стеклянной трубкой и кипятят под тягой в течение часа. После прекращения кипячения охлаждают, фильтруют. С фильтратом проделывают качественные реакции на определение составных частей нуклеопротеидов.
Проба Троммера на пентозы
Метод основан на окислении альдегидной группы рибозы и дезоксирибозы до карбоксильной, при этом гидроксид меди (II) восстанавливается в гидроксид или оксид меди (I) и выпадает в осадок.
К 10 каплям гидролизата добавляют 5 капель 10 % раствора NaOH до щелочной среды и добавляют по каплям 7% раствор сульфата меди CuSO4 до появления голубой мути, далее пробирку нагревают до кипения, при этом выпадает желтый осадок CuOH или образуется осадок меди Cu2O красного цвета. Внимание! Избыток CuSO4 мешает реакции, так как образующийся при нагревании Cu(OH)2 дает оксид меди (II) CuO черного цвета.
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2
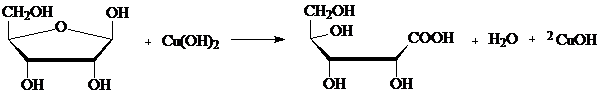
рибоза рибоновая кислота
2CuOH → H2O + Cu2O↓
Биуретовая реакция на белок
К 5 каплям гидролизата добавляют 10 капель 10% раствора NaOH до щелочной среды (проверить рН) и прибавляют 1 каплю 1% раствора CuSO4. В пробирке наблюдается характерное окрашивание.
Указания к составлению отчета. При составлении отчета написать в тетради схему полного распада нуклеопротеидов и химические формулы компонентов нуклеотидов.
Контрольные вопросы:
1. Какие белки входят в состав нуклеопротеидов и в чем состоит их особенность?
2. Какие типы нуклеиновых кислот вы знаете и какова их биологическая роль?
3. Какие углеводы и азотистые основания входят в состав ДНК и РНК?
Лабораторная работа №8
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АНТИБИОТИКИ
Цель работы – отработать методы идентификации различных групп антибиотиков.
Исследуемый материал: порошки эритромицина, тетрациклина и левомицетина.
Реактивы:
1. Концентрированная серная кислота.
2. 5% раствор FeCl3.
3. 10% раствор NaOH.
Оборудование:
1. Штатив с пробирками.
2. Пипетки.
Ход работы:
Лабораторная работа №9
ВЫДЕЛЕНИЕ АЛКАЛОИДОВ ИЗ ЧАЙНОГО ЛИСТА И КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АЛКАЛОИДЫ
Цель работы – овладеть навыками выделения алкалоидов из чайного листа и провести их качественное определение с помощью общеалкалоидных осадительных реактивов и специфической мурексиновой пробы на пуриновые алкалоиды.
Для проведения качественных реакций алкалоиды из сырья извлекают 5% HCl или CH3COOH в соотношении 1:10 кипячением в течение 5 минут.
Для идентификации алкалоидов в различных объектах очень широко используют осадительные общеалкалоидные реактивы. Известно около сотни таких реактивов, которые образуют с алкалоидами-основаниями нерастворимые в воде простые или комплексные соли. В данной работе используются: реактив Бушарда-Вагнера, раствор танина и раствор пикриновой кислоты. Осадительные реакции нередко используют для испытания подлинности препаратов алкалоидов. При выполнении этих реакций выпадают аморфные или кристаллические осадки. Последние часто имеют характерную температуру плавления, которая также может быть использована для идентификации алкалоида. Осадительные реактивы неспецифичны для алкалоидов. Они дают положительные реакции не только с алкалоидами, но и с большинством азотсодержащих органических соединений, в том числе с белками.
Для испытания подлинности пуриновых алкалоидов (кофеин, теофиллин, теобромин) используется мурексидная проба. Она основана на разрушении молекулы пурина при нагревании с окислителем (перекисью водорода, бромной водой, азотной кислотой и другими) и образовании смеси производных аллоксана и его изомера диалуровой кислоты. Взаимодействуя между собой, они образуют метилированные производные аллоксантина, которые под действием избытка раствора аммиака приобретают пурпурно-красное окрашивание. Окраска обусловлена появлением аммонийной соли метилированного производного пурпуровой кислоты. Мурексидная реакция неспецифична, она является общей для всех производных пурина.
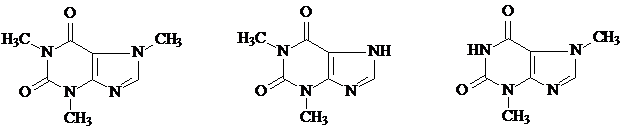
кофеин теофиллин теобромин
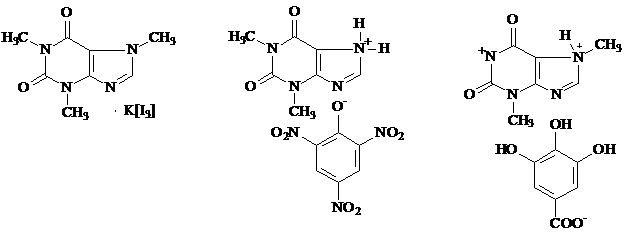
йодид кофеина пикрат теофиллина галлат теобромина
Химизм мурексидной реакции с кофеином:

аммонийная соль тетраметилпурпуровой кислоты
Материал исследования: чай черный или зеленый.
Реактивы:
1. 5% раствор HCl.
2. Раствор йода в йодиде калия (реактив Вагнера-Бушарда – 5 г йода и 10 г йодида калия растворить в 100 мл воды, можно воспользоваться раствором Люголя, который необходимо развести в 2 раза).
3. 10% свежеприготовленный раствор танина.
4. 1% раствор пикриновой кислоты.
5. 30% раствор азотной кислоты.
6. 10% раствор аммиака.
Оборудование:
1. Штатив с пробирками.
2. Пипетки.
3. Песчаная баня или спиртовка.
4. Выпарительная чашка.
Ход работы:
1 г черного или зеленого чая поместить в пробирку, залить 10 мл 5% раствора соляной кислоты и кипятить на спиртовке или песчаной бане в течение 5 минут, считая от момента закипания. Слить экстракт с осадка в другую пробирку и остудить.
Для проведения осадительных реакций в три пробирки налить по 1 мл приготовленного экстракта, в первую пробирку добавить 1 мл раствора йода в йодиде калия, во вторую – 1 мл раствора танина, в третью – 1 мл раствора пикриновой кислоты. Отметить цвет образующихся осадков.
Для проведения мурексидной пробы остаток экстракта перелить в выпарительную чашку, добавить 10 капель азотной кислоты и выпарить на песчаной бане досуха. Остаток смочить 1–2 каплями раствора аммиака и описать наблюдаемое изменение остатка.
Указания к составлению отчета. Написать формулы алкалоидов чайного листа, реакции идентификации, отметить цвета осадков.
Контрольные вопросы:
1. Что такое алкалоиды?
2. Почему экстракцию алкалоидов проводят подкисленным водным раствором?
3. Какая функциональная группа алкалоидов участвует в осадительных реакциях?
Список литературы
1. Руководство к практическим занятиям по биологической химии. / О.Д. Кушманова, Г.И. Ивченко. – М.: «Медицина», 1974.
2. Практикум по биологической химии. / Е.А. Строев, В.Г. Макарова. – М.: «Высшая школа», 1986.
3. Лабораторные методы исследования в клинике: справочник. / Под ред. В.В. Меньшикова. – М.: «Медицина», 1987.
4. Практикум по биохимии. / А.А. Чиркин. – Минск: «Новое знание», 2002.
Лицензия ЛР №020370
Составитель: Л.В. Аникина
Редактор, корректор И.А. Мангасарова
Подписано в печать 03.07.06.
Формат 60х90/16 Объем 2,0 п.л.
Тираж 50 Заказ 94/2006
Редакционно-издательский отдел
Пермского государственного технического университета
Кафедра химии и биотехнологии
