Водородный показатель. Гидролиз солей
Теоретические основы. Вода - слабый электролит, диссоциирует в незначительной степени с образованием ионов водорода Н+ и гидроксил-анионов ОН  : Н2О
: Н2О 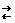 Н+ + ОН
Н+ + ОН  .
.
Состояние равновесия этой реакции характеризуется константой, которая называется ионное произведение воды:
К 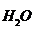 = [Н+ ]
= [Н+ ] 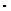 [ОН
[ОН  ] = 10
] = 10  14 (при 220С),
14 (при 220С),
где [Н+ ] и [ОН  ] - равновесные концентрации ионов.
] - равновесные концентрации ионов.
Обычно вместо величин [Н+] и [ОН  ] используют их отрицательные десятичные логарифмы. Эти величины называют соответственно водородным и гидроксильным показателями:
] используют их отрицательные десятичные логарифмы. Эти величины называют соответственно водородным и гидроксильным показателями:
рН = - lg [Н+ ]
рОН = - lg [ОН  ]
]
рК 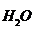 = рН + рОН = 14
= рН + рОН = 14
Нейтральные растворы не имеют избытка ионов  Н+ или ОН
Н+ или ОН  : [Н+ ] = [ОН
: [Н+ ] = [ОН  ] = 10
] = 10  7 ; рН = рОН = 7
7 ; рН = рОН = 7
Кислые растворы содержат избыток ионов Н+:
[Н+ ]> [ОН  ]; рН< рОН; рН<7; рОН>7
]; рН< рОН; рН<7; рОН>7
Щелочные растворы содержат избыток ионов ОН  :
:
[Н+ ]< [ОН  ]; рН> рОН; рН>7; рОН<7
]; рН> рОН; рН>7; рОН<7
Если растворенная в воде соль содержит ионы-остатки слабых кислот или слабых оснований, то происходит процесс гидролиза соли - обменной реакции ионов соли с молекулами воды, приводящей к образованию молекул и ионов новых слабых электролитов.
Основные правила написания реакций гидролиза:
1. Гидролизу подвергаются анионы слабых кислот и катионы слабых оснований, входящих в состав соли.
2. Гидролиз - процесс ступенчатый. На каждой ступени один гидролизующийся ион реагирует с одной молекулой воды.
3. В обычных условиях гидролиз протекает только по первой ступени. Гидролиз усиливается при нагревании и разбавлении растворов солей.
4. Гидролиз - процесс, как правило, обратимый, его равновесие можно смещать. Добавление одноименных ионов (Н+ или ОН  ), выделяющихся в процессе гидролиза, смещает равновесие в сторону уменьшения гидролиза. Добавление противоположных ионов, связывающих выделяющиеся ионы Н+ и ОН
), выделяющихся в процессе гидролиза, смещает равновесие в сторону уменьшения гидролиза. Добавление противоположных ионов, связывающих выделяющиеся ионы Н+ и ОН  в молекулы воды, смещает равновесие в сторону усиления гидролиза.
в молекулы воды, смещает равновесие в сторону усиления гидролиза.
Типы реакций гидролиза.
1. Соль образована ионами сильного основания и сильной кислоты (например, NaCl, KNO3 и др.).
NaCl + H2O  гидролиз не идет (NaOH - сильное основание, HCl - сильная кислота).
гидролиз не идет (NaOH - сильное основание, HCl - сильная кислота).
2. Соль образована ионами сильного основания и слабой кислоты (например, Na2CO3, KSCN и др.).
Na2CO3 + Н2О  гидролиз по аниону (NaOH - сильное основание, H2CO3 - cлабая кислота).
гидролиз по аниону (NaOH - сильное основание, H2CO3 - cлабая кислота).
CO32  + HOH
+ HOH 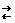 HCO3
HCO3  + OH
+ OH  (среда щелочная, рН>7).
(среда щелочная, рН>7).
Na2CO3+ HOH 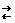 NaHCO3 + NaOH (1 ступень гидролиза).
NaHCO3 + NaOH (1 ступень гидролиза).
Добавление к раствору сильных щелочей (NaOH), содержащих одноименные ионы (OH  ), вызывает ослабление гидролиза (смещение равновесия влево по принципу Ле Шателье). Добавление к раствору кислот усиливает гидролиз за счет реакции Н++OH
), вызывает ослабление гидролиза (смещение равновесия влево по принципу Ле Шателье). Добавление к раствору кислот усиливает гидролиз за счет реакции Н++OH 
 Н2О, в результате которой концентрация ионов OH
Н2О, в результате которой концентрация ионов OH  в растворе уменьшается, и равновесие гидролиза смещается вправо. Гидролиз усиливается и начинает идти по второй ступени:
в растворе уменьшается, и равновесие гидролиза смещается вправо. Гидролиз усиливается и начинает идти по второй ступени:
НCO3  + HOH
+ HOH 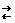 H2CO3 + OH
H2CO3 + OH 
NaНCO3 + HOH 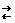 H2CO3 + NaOH (2 ступень гидролиза).
H2CO3 + NaOH (2 ступень гидролиза).
3. Соль образована ионами слабого основания и сильной кислоты (например, AlCl3, FeSO4 и др.).
AlCl3 + H2O  гидролиз по катиону (Al(OH)3 - слабое основание, НCl - cильная кислота).
гидролиз по катиону (Al(OH)3 - слабое основание, НCl - cильная кислота).
Al3+ + HOH 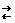 AlOH2+ + H+(среда кислая, рН<7)
AlOH2+ + H+(среда кислая, рН<7)
AlCl3 + HOH 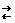 AlOHCl2 + HCl (1 ступень гидролиза).
AlOHCl2 + HCl (1 ступень гидролиза).
4. Соль образована ионами слабого основания и слабой кислоты:
а) соль растворима в воде (например, (NH4)2CO3, NH4NO2 и др.).
(NH4)2CO3 + H2O  гидролиз идет сразу по катиону и аниону:
гидролиз идет сразу по катиону и аниону:
2NH4+ + CO32  + HOH
+ HOH 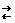 NH4OH + HCO3
NH4OH + HCO3  + NH4+ (рН
+ NH4+ (рН 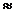 7)
7)
(NH4)2CO3 + HOH 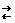 NH4OH + NH4HCO3
NH4OH + NH4HCO3
б) соль нерастворима в воде (например, FeS, ZnSiO3 и др.).
FeS + H2O  нерастворимые соли гидролизу не подвергаются;
нерастворимые соли гидролизу не подвергаются;
в) соль разлагается водой (в таблице растворимости стоит прочерк, например, Fe2S3, Al2(CO3)3 и др.). Гидролиз таких солей идет необратимо и до конца: Fe2S3+6H2O  2Fe(OH)3
2Fe(OH)3 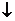 +3H2S
+3H2S 
Цель работы. C помощью универсальной индикаторной бумаги определить реакцию среды водных растворов солей, изучить влияние температуры и концентрации на гидролиз, взаимное усиление гидролиза растворов различных солей.
Порядок работы.
Опыт 1. Определение рН в кислых, щелочных и
Нейтральных средах
На предметное стекло положите небольшие кусочки универсальной индикаторной бумаги и стеклянными палочками нанесите на них по капле дистиллированной воды, растворов NaOH, NH4OH, HCl, CH3COOH. С помощью цветовой шкалы определите рН в нейтральной, щелочной и кислой средах.
Опыт 2. Определение реакции среды при гидролизе солей
В отдельные пробирки добавьте по нескольку кристалликов следующих солей: нитрата натрия, сульфита натрия, нитрата цинка, ацетата аммония. Растворите соли в 1-2 мл дистиллированной воды. На предметное стекло положите кусочки универсальной индикаторной бумаги и определите рН растворов солей.
Опыт 3. Влияние температуры на гидролиз
Налейте в пробирку 3-4 мл раствора ацетата натрия и добавьте 1-2 капли фенолфталеина. Разделите раствор на 2 пробирки и одну из них нагрейте на водяной бане. Сравните интенсивность окраски индикатора в обеих пробирках.
Опыт 4. Влияние концентрации раствора соли на гидролиз
Налейте в пробирку 1 мл раствора хлорида сурьмы и добавьте дистиллированной воды. Выпадение белого осадка связано с разложением хлорида дигидроксосурьмы, образующейся за счет гидролиза соли по второй ступени: Sb(OH)2Cl  SbOCl
SbOCl 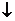 + H2O
+ H2O
Добавьте в пробирку раствор соляной кислоты до растворения осадка. Объясните смещение равновесия реакции гидролиза.
Опыт 5. Взаимное усиление гидролиза
Налейте в пробирку 1 мл раствора хлорида алюминия и добавьте равное количество раствора карбоната натрия. Объясните взаимное усиление гидролиза солей, приводящее к выделению оксида углерода (IV) и образованию осадка гидроксида алюминия. Используя амфотерные свойства гидроксида алюминия, докажите его образование.
Форма лабораторного отчета.
1. Название лабораторной работы.
2. Краткое описание, цель работы.
Опыт 1. Определение рН в кислых, щелочных и
Нейтральных средах
| Исследуемое вещество | Цвет универсальной индикаторной бумаги | рН | Реакция среды |
Опыт 2. Определение реакции среды при гидролизе солей
| Исследуемое вещество | рН раствора | Реакция среды | Уравнение реакции гидролиза соли в молекулярном и ионном видах |
Опыты 3-5 оформите по схеме:
а) название опыта;
б) уравнение реакций в молекулярной и ионной формах;
в) наблюдения и обсуждения;
г) выводы.
Типовые задачи.
1. Напишите в молекулярной и ионно-молекулярной формах уравнения реакций гидролиза следующих солей: ZnCl2, Fe(NO3)3, CH3COOK, MnSO4, Na3PO4, K2S, NH4Cl, (NH4)2CO3, Al2S3. Укажите реакцию среды.
2. Рассчитайте концентрацию ионов водорода в водном растворе, в котором концентрация ионов ОН- равна 3,9×10-9 моль/л.
3. Найти рН 0,0001 М раствора КОН при условии его полной диссоциации.
4. Найти рН 0,1 М раствора соляной кислоты при условии ее полной диссоциации.
5. Найти рН 0,005 М раствора H2SO4 при условии полной диссоциации.
6. Найти рН 0,5 М раствора Ва(ОН)2 при условии полной диссоциации.
7. Найти рН и степень диссоциации 0,1 М раствора СН3СООН, если константа ее диссоциации К = 1,8 10-5.
8. Найти рН и степень диссоциации 0,001 М раствора NH4OH, если константа его диссоциации К = 1,75 10-5.
9. Смешали 1 л 0,001 М раствора азотной кислоты и 1 л 0,0008 М раствора гидроксида натрия. Найти рН полученного раствора.
10. Смешали 1 л 0,03 М раствора HCl и 1 л 0,028 М раствора КОН. Найти рН полученного раствора.
Лабораторная работа 12
Общие свойства металлов
Теоретические основы. Металлы - это элементы, обычно имеющие на последнем энергетическом уровне не более трех электронов. В периодической системе элементов металлы расположены в главных подгруппах I-III групп (кроме Н и В) и в побочных подгруппах. Валентные электроны металлов слабо связаны с ядром, поэтому металлы являются типичными восстановителями (легко отдают электроны, превращаясь в положительно заряженные ионы). По активности металлы располагаются в ряд, называемый электрохимическимрядом напряжений или рядом активностей металлов. Металлы, стоящие в ряду активностей до водорода, имеют отрицательные значения стандартных электродных потенциалов (j0), а металлы, стоящие после водорода - положительные значения j0. Чем левее стоит металл, тем больше его активность.
Металлы реагируют с кислородом воздуха с образованием оксидов, а щелочные и щелочноземельные металлы - пероксидов и супероксидов: 4Li + O2  2Li2O (оксид лития)
2Li2O (оксид лития)
2Na + O2  Na2O2 (пероксид натрия)
Na2O2 (пероксид натрия)
К + О2  КО2 (супероксид калия)
КО2 (супероксид калия)
Металлы реагируют с неметаллами: 2Al +3S 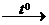 Al2S3 .
Al2S3 .
Активные металлы способны вытеснять водород из воды:
2Na + 2H2O  2NaOH + H2
2NaOH + H2 
Более активные металлы вытесняют менее активные из оксидов и солей: Cr2O3 + 2Al  Al2O3 + 2Cr
Al2O3 + 2Cr
Реакции металлов с кислотами:
1. Кислоты-неокислители (все кислоты, кроме H2SO4 конц. и HNO3 любой концентрации) реагируют только с металлами, стоящими в ряду напряжений до водорода. В результате реакции образуется соль и выделяется водород: 2Al+6HCl  2AlCl3+3H2
2AlCl3+3H2 
2. Кислоты-окислители (H2SO4 конц., HNO3 конц., HNO3 разб.) реагируют со всеми металлами, кроме Au и Pt. В результате образуются соль, вода и продукт восстановления кислоты, который зависит от концентрации кислоты и активности металла:
 SO2
SO2  (металлы, стоящие в ряду
(металлы, стоящие в ряду
напряжений после водорода)

 H2SO4. S
H2SO4. S  (металлы, стоящие в ряду напряжений
(металлы, стоящие в ряду напряжений
конц между водородом и цинком)
H2S  (металлы, стоящие в ряду
(металлы, стоящие в ряду
напряжений до цинка)
 NO2
NO2  (тяжелые металлы)
(тяжелые металлы)
 HNO3
HNO3
конц.
N2O  (активные металлы)
(активные металлы)
 NO
NO  (тяжелые металлы)
(тяжелые металлы)
 HNO3
HNO3
разб.
N2  (активные металлы)
(активные металлы)
Например, Cu + 2H2SO4 конц.  CuSO4 + 2H2O + SO2
CuSO4 + 2H2O + SO2 
Cu + 4HNO3 конц.  Cu(NO3)2 + 2H2O + 2NO2
Cu(NO3)2 + 2H2O + 2NO2 
3Cu + 8HNO3 разб.  3Cu(NO3)2 + 4H2O + 2NO
3Cu(NO3)2 + 4H2O + 2NO 
Металлы, стоящие в ряду напряжений до алюминия, восстанавливают очень разбавленную азотную кислоту до NH4NO3: Сa+10HNO3оч.разб.  4Ca(NO3)2 +3H2O+NH4NO3
4Ca(NO3)2 +3H2O+NH4NO3
Коэффициенты в вышеуказанных реакциях расставляются по правилам окислительно-восстановительных реакций.
Концентрированные серная и азотная кислоты пассивируют такие металлы, как железо, алюминий, хром и некоторые другие, покрывая их прочной оксидной пленкой, которая препятствует дальнейшему окислению.
Цель работы. Изучить общие химические свойства металлов.
Порядок работы.
Опыт 1. Взаимодействие металлов с кислородом
Кусочек магниевой стружки внесите в тигельных щипцах в пламя газовой горелки и наблюдайте его горение. Внесите продукт сгорания магния в пробирку, добавьте дистиллированной воды и встряхните. Испытайте полученный раствор фенолфталеином.
Опыт 2. Взаимодействие металлов с водой
Приготовьте пять пробирок с 3-4 мл дистиллированной воды.
а). В первую пробирку внесите небольшой кусочек натрия и наблюдайте реакцию (реакция проводится в вытяжном шкафу!). Испытайте полученный раствор фенолфталеином.
б). Во вторую пробирку внесите кусочек кальция реакцию (реакция проводится в вытяжном шкафу!). Сравните скорость выделения водорода в реакциях натрия и кальция с водой. Испытайте полученный раствор фенолфталеином.
в). В третью пробирку поместите небольшой кусочек магния. Идет ли реакция при комнатной температуре? Осторожно нагрейте пробирку на газовой горелке.
г). В четвертую пробирку внесите кусочек алюминиевой проволоки. Идет ли реакция при комнатной температуре? При нагревании?
д). В пятую пробирку внесите кусочек алюминиевой проволоки, предварительно зачищенной наждачной бумагой. Идет ли реакция при комнатной температуре? При нагревании?
Опыт 3. Взаимодействие металлов с галогенами
Для проведения опыта необходимо сначала получить хлор по нижеприведенной реакции:
KMnO4 + HCl конц.  Сl2
Сl2  + MnCl2 + KCl + H2O
+ MnCl2 + KCl + H2O
(коэффициенты в этой реакции поставьте самостоятельно).
а). Откройте кран капельной воронки установки для получения хлора таким образом, чтобы кислота капала в колбу с частотой примерно 1 капля в 7 секунд. Заполните хлором коническую колбу и закройте ее пробкой (реакция проводится в вытяжном шкафу!). Перекройте кран капельной воронки.
б). В ложечке для сжигания нагрейте железные опилки до красного каления и опустите ложечку в колбу с хлором. После окончания реакции и конденсации паров хлорида железа (III) налейте в колбу 10-15 мл дистиллированной воды и перемешайте содержимое колбы. Разлейте полученный раствор на две пробирки и проведите качественные реакции на ионы Fe3+ и Cl  :
:
- в одну пробирку добавьте раствор нитрата серебра; в присутствии ионов Cl  выпадает белый осадок хлорида серебра;
выпадает белый осадок хлорида серебра;
- в другую пробирку добавьте раствор роданида калия или роданида аммония; в присутствии ионов Fe3+ раствор окрашивается в кроваво-красный цвет за счет образования роданида железа (III).
Опыт 4. Взаимодействие металлов с кислотами-
Неокислителями
В четыре пробирки налейте по 2 мл 2N раствора серной кислоты. Поместите в кислоту по кусочку следующих металлов: магния, цинка, железа, меди. Сравните интенсивность протекания реакции в каждой пробирке и сделайте выводы. Расположите металлы в порядке возрастания их активности.
Опыт 5. Взаимодействие металлов с кислотами-
окислителями
(опыт проводится в вытяжном шкафу!).
Последовательно проведите реакции меди, железа и цинка с разбавленной азотной, концентрированной азотной и серной кислотами. Если реакция не идет при комнатной температуре, осторожно нагрейте пробирку.
Опыт 6. Вытеснение одних металлов другими из солей
Проведите реакции взаимодействия:
а) раствора сульфата меди с железом;
б) раствора сульфата железа с медью;
в) раствора нитрата свинца с цинком.
Форма лабораторного отчета.
1. Название лабораторной работы.
2. Краткое описание, цель работы.
3. Номер и название опыта.
4. Уравнения реакций в молекулярной и ионной формах.
5. Наблюдения.
6. Обсуждения.
7. Выводы.
Контрольные вопросы.
1. С чем связаны восстановительные свойства металлов?
2. Приведите примеры реакций металлов: а) с кислородом; б) с водой; в) с кислотой - неокислителем; г) с кислотой-окислителем; д) с солью.
Семинар 2
Гальванические элементы
Типовые задачи.
1. Какой из металлов будет растворяться при работе гальванического элемента Cu | Cu2+ || Ag+ | Ag при концентрации электролитов, равных 1 моль/л ?
2. Какой из металлов будет растворяться при работе гальванического элемента Zn | Zn2+ || Al3+ | Al при концентрации электролитов, равных 1 моль/л ?
3. Какой из металлов будет служить анодом при работе гальванического элемента Ni | Ni2+ || Fe2+ | Fe при концентрации электролитов, равных 1 моль/л ?
4. Какой из металлов будет служить анодом при работе гальванического элемента Mg | Mg2+ || Zn2+ | Zn при концентрации электролитов, равных 1 моль/л ?
5. В каком направлении будут перемещаться электроны во внешней цепи при работе гальванического элемента Ni | Ni2+ || Al3+ | Al при концентрации электролитов, равных 1 моль/л ?
6. В каком направлении будут перемещаться электроны во внешней цепи при работе гальванического элемента Hg | Hg2+ || Ag+ | Ag при концентрации электролитов, равных 1 моль/л ?
7. Вычислить ЭДС стандартного медно-никелевого элемента.
8. Вычислить ЭДС стандартного хромово-алюминиевого элемента.
9. Вычислить потенциал цинкового электрода, опущенного в раствор сульфата цинка с концентрацией 0,01 моль/л.
10. Вычислить потенциал ртутного электрода, опущенного в раствор нитрата ртути (II) с концентрацией 0,001 моль/л.
11. Вычислить потенциал водородного электрода при рН = 5.
12. Вычислить потенциал водородного электрода при рН = 12.
13. Найти ЭДС гальванического элемента, состоящего из меди, опущенной в 0,01 М раствор сульфата меди, и цинка, опущенного в 0,1 М раствор сульфата цинка.
14. Найти ЭДС гальванического элемента, состоящего из серебра, опущенного в 0,01 М раствор нитрата серебра, и алюминия, опущенного в 0,001 М раствор нитрата алюминия.
15. Найти ЭДС гальванического элемента, состоящего из двух водородных электродов, опущенных в растворы с рН = 2 и рН = 10.
16. Гальванический элемент составлен из стандартного цинкового электрода и хромового электрода, погруженного в раствор нитрата хрома (III). При какой концентрации ионов Cr3+ ЭДС этого элемента будет равна нулю ?
Лабораторная работа 13
Коррозия металлов
Теоретические основы. Процесс разрушения веществ под действием окружающей среды называется коррозией. Коррозия делится на химическую (разрушение металлов в агрессивной среде) и электрохимическую. При контакте двух металлов во влажном воздухе возникают микрогальванические пары, приводящие к протеканию электрохимической коррозии металлов. В процессе электрохимической коррозии более активный металл, имеющий более отрицательное значение стандартного электродного потенциала, отдает электроны и переходит в раствор. Электроны от него перемещаются к менее активному металлу и участвуют в восстановительных процессах ионов и молекул, находящихся в окружающей микрогальваническую пару среде.
В кислых растворах идет процесс водородной деполяризации: 2Н+ + 2е  Н2
Н2 
В нейтральных и щелочных средах идет процесс с участием растворенного кислорода воздуха - кислородная деполяризация: О2 + 2Н2О + 4е  4ОН
4ОН 
 Пример Коррозия контакта Cu / Zn , среда - КОН.
Пример Коррозия контакта Cu / Zn , среда - КОН.
Zn: Zn - 2e  Zn2+
Zn2+  2
2
Cu: О2 + 2Н2О + 4е  4ОН
4ОН 
 1
1
 |
Zn+O2+2H2O 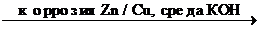 2Zn(OH)2
2Zn(OH)2
Цель работы. Изучение различных случаев коррозии металлов и методов защиты от коррозии.
Порядок работы.
Опыт 1. Коррозия оцинкованного и луженого железа
Зачистите наждачной бумагой две железные проволочки. Прикрепите к одной из них гранулу цинка, а к другой - гранулу олова. Опустите проволочки в отдельные пробирки. В каждую пробирку добавьте по 2-3 мл дистиллированной воды, 5 капель 2N раствора серной кислоты и 1 каплю раствора гексацианоферрата (III) калия K3[Fe(CN)6]. Сравните изменения в обеих пробирках.
Примечание. Гексацианоферрат (III) калия K3[Fe(CN)6] используют для качественной реакции на ион Fe2+. В присутствии ионов двухвалентного железа образуется темно-синий осадок KFe[Fe(CN)6].
Опыт 2. Коррозия железа в присутствии меди
В стакан объемом 50 мл налейте дистиллированную воду, растворите в ней немного хлорида натрия (катализатор коррозии), добавьте 1 мл раствора гексацианоферрата (III) калия и несколько капель раствора фенолфталеина. Опустите в стакан перевитые медную и железную проволочки. Через несколько минут отметьте наблюдаемые явления.
Опыт 3. Катализаторы (стимуляторы) коррозии
Налейте в пробирку 2 мл 2N раствора соляной кислоты и опустите в нее алюминиевую проволочку. Идет ли реакция? Добавьте в пробирку небольшое количество кристаллического хлорида натрия. Запишите наблюдения.
Опыт 4. Защита от коррозии. Оксидирование
Зачистите наждачной бумагой 2 железных гвоздя и один из них поместите на 5 минут в пробирку с концентрированной азотной кислотой. Промойте гвозди водой и опустите их в стакан с разбавленной серной кислотой. Сравните интенсивность выделения газа в обоих случаях.
Опыт 5. Защита от коррозии. Ингибирование
В две пробирки поместите немного железных опилок, добавьте в одну из них 1 мл раствора формалина (СН2О) и прилейте в каждую пробирку по 2 мл разбавленной соляной кислоты. Сравните интенсивность выделения газа в каждой пробирке.
Форма лабораторного отчета.
1. Название лабораторной работы.
2. Краткое описание, цель работы.
3. Номер и название опыта.
4. Значения стандартных электродных потенциалов металлов, катод и анод микрогальванической пары.
5. Уравнения электрохимических процессов, идущих на аноде и на катоде.
6. Наблюдения и обсуждения.
7. Выводы.
Типовые задачи.
1. Написать уравнения химических реакций, протекающих при коррозии следующих сплавов (контактов): а) Cu/Cr, среда HCl; б) Zn/Al, среда KOH; в) Fe/Sn, среда H2O; г) Ag/Cu, среда H2SO4; д) Fe/Zn, среда KCl; е) Mg/Zn, среда NaOH.
2. Предложить анодное покрытие для защиты цинка от коррозии. Обосновать и указать достоинства и недостатки способа.
3. Предложить катодное покрытие для защиты меди от коррозии. Обосновать и указать достоинства и недостатки способа.
Лабораторная работа 14
