Углеводороды нефтей и нефтепродуктов
Введение.
Нефть представляет собой сложную смесь соединений, состоящих в основном из углеводородов. Углеводороды нефтей представляют собой алканы, циклоалканы (нафтены), арены, а также углеводороды смешанного строения.
При добыче нефти её часто сопровождают попутные газы. В основном это также углеводороды (низкомолекулярные алканы). В результате различных процессов нефтепереработки и нефтехимии получают, наряду с насыщенными, также непредельные углеводороды – алкены, алкадиены, алкины.
Целью данной работы является ознакомление с некоторыми методами получения и химическими свойствами отдельных представителей указанных выше типов углеводородов, входящих в состав нефтей и нефтепродуктов.
Алканы (предельные, метановые, насыщенные, парафины) – это углеводороды, в состав молекул которых входят атомы углерода, связанные только одинарными связями. Общая формула алканов - СnН2n+2. Все атомы углерода находятся в состоянии гибридизации sp3, все связи в алканах равноценны и находятся под тетраэдрическим углом друг к другу.
В химическом отношении при обычных условиях алканы малореакционноспособны. К настоящему времени известны следующие основные типы реакций, в которые вступают алканы: реакции замещения водорода (проходят по радикальному механизму, часто только при облучении), реакции окисления, дегидрирования, крекинга (т.е. идущие с расщеплением связей С-С).
Алкены (этиленовые, непредельные, ненасыщенные, олефины) – углеводороды, в молекулах которых между двумя атомами углерода имеется двойная связь. Атомы углерода при двойной связи находятся в состоянии гибридизации sp2. Двойная связь представляет собой сочетание одинарной s-связи, образованной за счет осевого перекрывания гибридизованных sp2-орбиталей, и p-связи, образованной за счет бокового перекрывания негибридизованных р-орбиталей. Общая формула алкенов СnН2n.
Алкены – это самый реакционноспособный тип углеводородов. В основном реакции идут за счет раскрытия двойной p-связи под действием различных реагентов, поскольку p-связь намного слабее, чем s-связь. Основные типы реакций алкенов - присоединение по месту разрыва двойной связи, полимеризация, окисление.
Циклоалканы (полиметиленовые, циклопарафины) – являются, как и алканы, предельными, насыщенными углеводородами, все атомы углерода в которых находятся в состоянии гибридизации sp3. Атомы углерода в незамещенных циклоалканах замкнуты в цикл. В нефтях найдены циклические углеводороды с пятью и шестью атомами углерода в цикле, поэтому такие циклоалканы получили название нафтенов. Общая формула циклоалканов СnН2n.
По химическим свойствам нафтены похожи на алканы, т.е. малореакционноспособны. Из особых реакций следует отметить реакцию дегидрирования шестичленных нафтенов (реакция Зелинского), которая даёт возможность получать из низкооктановых нафтенов высокооктановые арены.
Арены (ароматические углеводороды) – углеводороды, в состав молекул которых входит особая группировка - бензольное кольцо ( 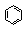 ). Атомы углерода в бензольном кольце находятся в состоянии гибридизации sp2. Общая формула простейших аренов СnН2n-6.
). Атомы углерода в бензольном кольце находятся в состоянии гибридизации sp2. Общая формула простейших аренов СnН2n-6.
Арены вступают в реакции замещения в бензольном кольце (галогенирование, нитрование, сульфирование, алкилирование, ацилирование), в реакции окисления, присоединения, замещения водорода в боковых цепях (последние аналогичны реакциям алканов).
Наиболее характерными для аренов являются реакции замещения водорода в бензольном кольце. При наличии в бензольном кольце заместителей следующая группа встает не в любое, а в строго определенное положение по отношению к первой. Заместители, которые облегчают проведение реакций и посылают следующую группу в орто-, и пара-положения по отношению к себе, называются заместителями (ориентантами) I рода. Это алкильные группы Alk- (CH3-, C2H5- и т.п.), группы –ОН, NH2, а также галогены (однако последние затрудняют протекание реакции). Заместители, которые затрудняют реакции и посылают следующую группу в мета-положение по отношению к себе, называются заместителями (ориентантами) II рода. К ним относятся: -NO2, -SO3H, -COOH, -CºN, -СHO.
Арены являются высокооктановыми компонентами моторных топлив, однако часто токсичными. Циклоалканы и нормальные (неразветвленные) алканы обладают низкими октановыми числами. Наиболее ценными компонентами бензинов являются разветвленные алканы.
Порядок выполнения работы
Алканы и циклоалканы
Опыт 1. Химические свойства гексана и циклогексана.
Гексан и циклогексан представляют собой бесцветные прозрачные жидкости с характерным запахом. Температуры их кипения 68,7 0С и 81,4 0С соответственно, плотности 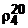 =0,6548 и 0,7786 г/см3.
=0,6548 и 0,7786 г/см3.
а) отношение к кислотам
В две пробирки наливают по 1 мл гексана и циклогексана, затем в каждую добавляют по ~1 мл конц. H2SO4. Встряхивают пробирки, отмечают отсутствие протекания в них каких-либо реакций.
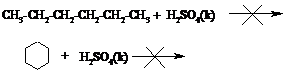
б) отношение к щелочам
Повторяют опыт а), но вместо кислоты в пробирки добавляют раствор щелочи NaOH. Реакции также не идут.
в) отношение к окислителям
В качестве окислителя используют раствор перманганата калия, однако обесцвечивание раствора KMnO4 не происходит даже при встряхивании и нагревании.
г) отношение к галогенам
В две пробирки, содержащие по 1 мл гексана и циклогексана, добавляют по несколько капель бромной воды желтого цвета. Обесцвечивания растворов не происходит.
Опыт 2. Получение и свойства этилена.
Готовят заранее две пробирки: с бромной водой и с раствором перманганата калия. В третью, сухую пробирку помещают 1 мл этилового спирта и осторожно приливают 2 мл концентрированной серной кислоты. В разогревшуюся смесь бросают кипелку, закрывают пробирку газоотводной трубкой и начинают медленно и осторожно нагревать до начала равномерного выделения газа. Реакция внутримолекулярной дегидратации (отщепление воды) протекает по уравнению:
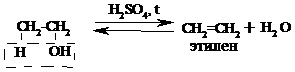
Возможно также протекание побочной реакции межмолекулярной дегидратации:
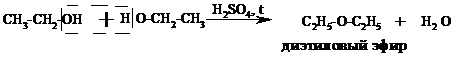 Реакционная смесь при этом часто темнеет из-за образования углерода:
Реакционная смесь при этом часто темнеет из-за образования углерода:
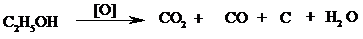
Как только из реакционной пробирки начинает выделяться этилен, опускают газоотводную трубку поочередно в пробирки с бромной водой и перманганатом калия. Наблюдают, как при пропускании газа через приготовленные растворы они постепенно обесцвечиваются (во время опыта полезно подводящую газ трубочку время от времени вынимать из пробирок с раствором брома и перманганата калия и встряхивать их) в результате протекания следующих реакций:
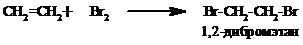
Галогенирование (присоединения брома):
Окисление:
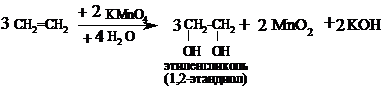
Затем, не прекращая нагревания пробирки со смесью спирта и кислоты, газоотводную трубку поворачивают отверстием вверх и зажигают выделяющийся этилен.

Опыт 3. Бромирование 1-гексена и циклогексена.
В одну пробирку наливают 1 мл 1-гексена, в другую-1 мл циклогексена. Добавляют в каждую ~0,5 мл бромной воды. Встряхивают пробирки, наблюдают почти мгновенное исчезновение брома в обеих пробирках в результате протекания реакции бромирования:
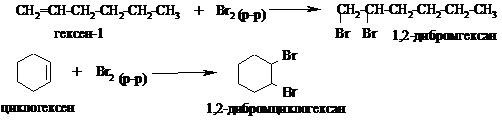
Опыт 4. Получение и свойства ацетилена.
В сухую пробирку помещают кусочки карбида кальция, затем прикапывают насколько капель воды и быстро закрывают пробирку пробкой с газоотводной трубкой. В пробирке наблюдается вспенивание за счет выделения газа. Опустите газоотводную трубку в пробирки с заранее приготовленными растворами бромной воды и перманганата калия. Наблюдается обесцвечивание растворов:
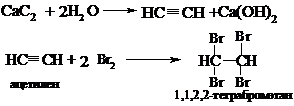
Опыт 5. Бромирование стирола.
В пробирку помещают ~1 мл стирола и добавляют 1¸2 мл бромной воды. Пробирку встряхивают и наблюдают обесцвечивание бромной воды.
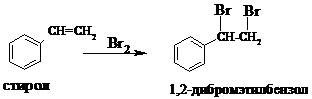
Арены
Опыт 6. Бромирование бензола и толуола
В две пробирки наливают по 1 мл бензола, в третью – 1 мл толуола. В одну из пробирок с бензолом и с толуолом добавляют ~0,5 г катализатора – железа. Приливают во все три пробирки ~ по 0,5 мл р-ра брома в тетрахлорметане (CCl4). Нагревают пробирки при встряхивании на водяной бане. Наблюдают, что в пробирке с бензолом без катализатора изменений не происходит, реакция не идет. В остальных случаях происходит постепенное исчезновение окраски брома.

Опыт 7. Окисление толуола.
В две пробирки помещают по несколько капель (3-4 капли) раствора перманганата калия и разбавленной серной кислоты и затем добавляют в одну пробирку ~0,5 мл бензола, а в другую – такое же количество толуола. Сильно встряхивают обе пробирки. Наблюдают, что смесь, содержащая бензол, не изменяет окраски, а в пробирке с толуолом розовая окраска постепенно исчезает.
Бензол весьма устойчив к действию окислителей, а гомологи бензола окисляются сравнительно легко с образованием бензойной кислоты:
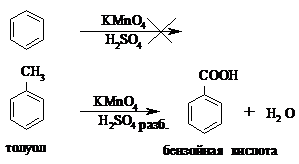
Опыт 8. Нитрование нафталина.
В пробирку с ~0,5 г нафталина добавляют 2 мл концентрированной азотной кислоты. При встряхивании смесь начинает желтеть уже при комнатной температуре. Смесь нагревают на кипящей водяной бане 5 мин и выливают в пробирку с холодной водой, a-нитронафталин выделяется в виде оранжевого масла, быстро твердеющего при встряхивании:
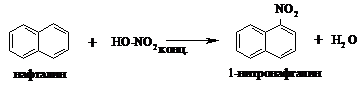
Опыт 9. Конденсация с формалином (формалитовая реакция – качественная проба на присутствие ароматических соединений).
В маленькую фарфоровую чашечку наливают 4 капли чистой концентрированной серной кислоты, затем прибавляют 2 капли формалина и 2-3 капли испытуемого продукта (сначала гексана, затем толуола). При отсутствии ароматических углеводородов смесь остается бесцветной или слегка желтеет. Яркое окрашивание, а часто выделение осадков указывает на наличие ароматических углеводородов. Если реакция получилась неясной, в конце нужно добавить еще 2-3 капли серной кислоты:
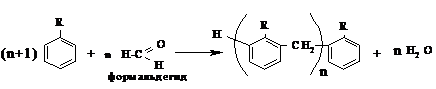
Задания к лабораторной работе:
1. Напишите реакции хлорирования для 2,4,4-триметилгексана, этилизопропилацетилена, симм-метилизобутилэтилена, метилдиэтилвтор-бутилметана. Укажите условия и назовите продукты.
2. Напишите реакции гидробромирования для несимм-этилизопропилэтилена, дипропилацетилена, 2,4-диметилпентена-2, 2,3-диметилгексана.
3. Напишите реакция взаимодействия разбавленного раствора перманганата калия с пентаном, 3-этилгексеном-2, α,α -диметил-β-изобутилэтилена, диметилацетилена.
Вопросы для самоконтроля:
1. Реагируют ли пентан и циклопентан с бромной водой и с раствором перманганата калия?
2. Напишите схемы реакций бромирования: а) этилена; б) пропилена; в) ацетилена; г) метилацетилена; д) стирола.
Нужен ли в данных реакциях катализатор?
3. Напишите схемы реакций гидробромирования: а) этилена; б) пропилена; в) ацетилена; г) метилацетилена.
4. Сформулируйте правило Марковникова и правило Зайцева.
5. Напишите схемы реакций дегидратации, протекающих при нагревании с серной кислотой: а) этанола; б) 2-бутанола; в) 2-метил-2-пропанола.
Назовите образующиеся соединения.
6. Напишите схему получения ацетилена из карбида кальция.
7. Напишите схему реакций окисления раствором перманганата калия:
а) этилена (на холоду); б) пропилена (на холоду); в) 2-пентена (при добавлении конц. серной кислоты и нагревании); г) ацетилена; д) толуола (при нагревании); е) этилбензола (при нагревании).
8. Какие заместители активируют бензольное кольцо, а какие дезактивируют?
9. Напишите схемы реакций бромирования:
а) толуола; б) анилина; в) фенола; г) нитробензола.
Укажите, в каких случаях необходимо использовать катализатор. Назовите образующиеся соединения.
10. Напишите схемы реакций сульфирования:
а) бензола; б) толуола; в) фенола.
Назовите образующиеся соединения.
11. Напишите схемы реакций нитрования:
а) бензола; б) толуола; в) нафталина.
Назовите образующиеся соединения.
12. В чем суть «формалитовой реакции»? Напишите схему этой реакции.
Лабораторная работа № 3
