В случае химической реакции, протекающей без изменения объёма системы, изменение внутренней энергии равно взятому с обратным знаком тепловому эффекту этой реакции.
Чаще всего химические реакции протекают при постоянном давлении. При этом удобно пользоваться величиной энтальпии Н, определяемой соотношением: H=U+pV. При постоянном давлении и при условии, что в ходе реакции совершается только работа расширения (А=p 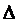 V):
V): 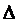 H=
H= 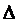 U+p
U+p 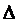 V или
V или 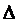 U=
U= 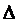 H-p
H-p 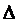 V. Учитывая, что
V. Учитывая, что 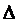 U=Q-A получаем:
U=Q-A получаем: 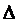 H=QP при указанных условиях, где QP – теплота, поглощённая системой при постоянном давлении. В случае химической реакции изменение энтальпии равно взятому с обратным знаком тепловому эффекту реакции, проведённой при постоянном давлении. Изменение внутренней энергии или энтальпии принято относить к тому случаю, когда все исходные вещества и все продукты реакции находятся в стандартных состояниях. Стандартным состоянием вещества называется его состояние в виде чистого вещества при давлении, равном нормальному атмосферному давлению (101,325 кПа) и температуре 250 С (2980 К).
H=QP при указанных условиях, где QP – теплота, поглощённая системой при постоянном давлении. В случае химической реакции изменение энтальпии равно взятому с обратным знаком тепловому эффекту реакции, проведённой при постоянном давлении. Изменение внутренней энергии или энтальпии принято относить к тому случаю, когда все исходные вещества и все продукты реакции находятся в стандартных состояниях. Стандартным состоянием вещества называется его состояние в виде чистого вещества при давлении, равном нормальному атмосферному давлению (101,325 кПа) и температуре 250 С (2980 К).
Стандартное изменении энтальпии при химической реакции обозначается: 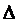 H0298.
H0298.
Стандартная энтальпия реакции образования 1 моль данного вещества из простых веществ называется стандартной энтальпией образования этого вещества. Эту величину обычно выражают в кДж/моль. Следовательно, энтальпия и внутренняя энергия образования простых веществ равны 0.
Энергетические изменения, происходящие в ходе реакции, изучаются в разделе химии – термохимии.
Химические уравнения, в которых указаны изменения энтальпии (тепловые эффекты реакций) называются термохимическими уравнениями.
В основе термохимии лежит закон Г. И. Гесса: тепловой эффект химической реакции зависит только от начального и конечного состояний участвующих в реакции веществ, и не зависит от промежуточных стадий процесса.
Практически важно и следствие из закона Гесса: стандартное изменение энтальпии химической реакции равно сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ. При каждом суммировании следует учитывать число молей участвующих в реакции веществ в соответствии с уравнением реакции: 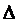 H0298= å nкон
H0298= å nкон 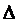 H0f кон – ånнач
H0f кон – ånнач 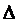 H0fнач – тепловой эффект реакции, где
H0fнач – тепловой эффект реакции, где
n – число молей, участвующих в реакции веществ,
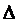 H0fнач – теплоты образования начальных веществ,
H0fнач – теплоты образования начальных веществ,
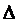 H0f кон - теплоты образования конечных веществ.
H0f кон - теплоты образования конечных веществ.
Направление, в котором самопроизвольно протекает химическая реакция, определяется совместным действием двух факторов: 1) тенденцией к переходу системы в состояние с наименьшей энтальпией (в случае изобарных процессов) и 2) тенденцией к достижению наиболее вероятного состояния.
Мерой вероятности состояния системы в термодинамике считают энтропию (S). Размерность энтропии Дж/моль∙К. Энтропия возрастает при переходе вещества из кристаллического состояния в жидкое и из жидкого в газообразное, при растворении кристаллов, при расширении газов, при химических взаимодействиях, приводящих к увеличению числа частиц, и прежде всего частиц в газообразном состоянии. Напротив, все процессы, в результате которых упорядоченность системы возрастает (конденсация, полимеризация, сжатие, уменьшение числа частиц), сопровождаются уменьшением энтропии. Изменение энтропии системы в результате химической реакции равно сумме энтропий продуктов реакции за вычетом суммы энтропий исходных веществ. Суммирование ведётся так же с учётом числа молей участвующих в реакции веществ.
Критерием самопроизвольности протекания химической реакции служит энергия Гиббса: G=H-T∙S. Изменение энергии Гиббса в результате химической реакции равно сумме энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ, суммирование производят с учётом числа молей, участвующих в реакции веществ.
При постоянстве температуры и давления химические реакции могут самопроизвольно протекать только в таком направлении, при котором энергия Гиббса системы уменьшается ( 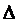 G<0). Значения S0298,
G<0). Значения S0298, 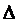 H0298,
H0298, 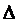 G0298 образования некоторых веществ являются табличными данными и приведены в приложении.
G0298 образования некоторых веществ являются табличными данными и приведены в приложении.
ХИМИЧЕСКАЯ КИНЕТИКА.
