Р-ции обмена в р-рах электролитов.
1. образование осадка.
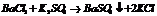
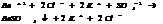
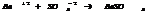
2. обр-ние газообразного в-ва.
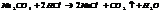
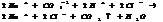
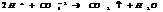
3. обр-ние слабого электролита.
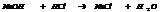
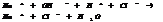
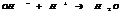
7.17. Гидролиз солей – это взаимодействие соли с водой. Ему подвергаются соли, в состав γ входит анион или катион слабого электролита.
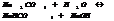
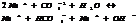
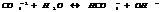
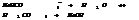
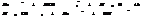
Константа и степень гидролиза.
Константа гидролиза хар-ет способность данной соли подвергаться гидролизу; чем больше константа, тем в больше степени протекает гидролиз.
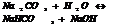
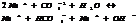
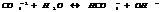
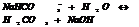
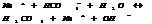
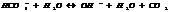
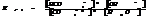
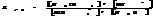
KГ1>>KГ2
Степень гидролиза зависит от константы гидролиз и концентрации. Степень гидролиза и константа гидролиза связаны соотношением.
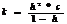
7.19. Смещение равновесия гидролиза.
Соли Al, Fe(3), Cr(3) в присутствии др. солей подвергаются полному гидролизу.
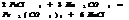
+
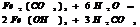
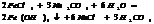
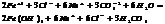
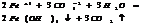
7.20. Ступенчатый гидролиз.
Соли, обр-ные слабыми электролитами многоосновными кислотами.
Ступень
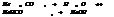
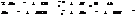
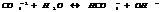
Ступень
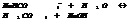
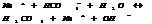
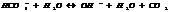 2. соли, обр-ые слабыми электролитами основаниями многовалентных Ме.
2. соли, обр-ые слабыми электролитами основаниями многовалентных Ме.
Ступень
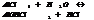
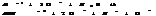
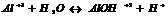 2. ступень
2. ступень
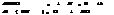
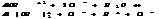
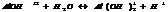 3. ступень.
3. ступень.
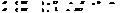
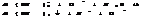
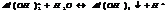
Степень окисления элемента и в-ва.
Степени окисленности эл-та опр-ся как число электронов, смещённых от атома данного эл-та к атому др. эл-та при положительной окислености или от атома др. эл-та к атому данного эл-та при отрицатеоьной окислености. При опр-ие СО руководствуются след. правилами:
1. СО простых в-в=0
Na0 H20
2. Суммарная СО эл-тов, входящих в в-во=0
H2SO4 2(+1)+(+6)+4(-2)=0
3. Постоянную СО имеют:
-щелочные МЕ
K+1Cl
- щелочно-земельные Ме (гл. подгр. 2 гр)
- Be, Mg
- Основная СО Н2=+1 искл: гидриды Ме CaH2-
- Основная СО О2= -2, искл: пероксиды Na2O2-, фторид кислорода F2O+2
8.2. Окислитель и восстановитель.
Отдача атомов электронов, сопровождающаяся повышением его СО наз-ся окислением. Присоединение атомов электронов, сопровождающаясее понижением его СО наз-ся восстановлением. В-во, содержащие восстанавливающиеся электроны наз-ся окис-ль; в-во, содержащие окисляющейся эл-т, наз-ся восст-ль. Ок-ми и восст-ми м.б. как простые, так и сложные в-ва. Восст-ми м.б. Ме и неМе, из сложных в-в, т.е. γ содержат эл-т в нисшей СО. Ок-ми м.б. неМе и сложные в-ва, содержащие эл-т высшей СО. Если В-во содержит эл-т промежуточной СО, то в зависимости от в-в, с γ взаимодейстует данное в-во, оно м. проявл-ть как окисл-ые, так мвосст-ые св-ва (окислительно-восстановительную двойственность).
S0 , H2S-2 , H2SO3+4 , H2SO4+6
8.3. Ок-но – восст-ые р-ции.
Ок-но – восст-ми наз-ся р-ции, в ходе γ меняется СО 1 или нескольких эл-тов. Различают 3 типа ок-но – восст-ых р-ций:
1. р-ции межмолкулярного окисления-восстановления.
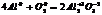
Al0 – 3 =Al+3 4 ок-ся, в-ль
О02+4 =2О-2 3 в-ся, о-ль
2. р-ции самоокисления, свмовосстановления (р-ции диспропорционинрования).
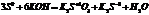
S0-4 =S+4 1 ок-ся, в-ль
S0+2 =S-2 2 в-ся, ок-ль
3. р-ции внутримолекулярного окис-ия-восст-ия.
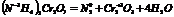 2N—6 =N2 ок-ся, в-ль (NH4)2Cr2O7
2N—6 =N2 ок-ся, в-ль (NH4)2Cr2O7
Cr+6+3 =Cr+3 в-ся, ок-ль (NH4)2Cr2O7
Составление ур-ний р-ций.
1. метод электронного баланса.
2. метод полуреакции.
По методу электр. баланса: кол-во электронов, отданное в-лем должно= кол-ву электронов, принятых ок-лем. Этот метод исп-ся, если известны все продукты р-ции.
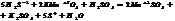 S-2-2 =S0 5ок-ся, в-ль H2S
S-2-2 =S0 5ок-ся, в-ль H2S
Mn+7+5 =Mn+2 2 в-ся, о-ль KMnO4
Метод полур-ции исп-ся, если известны не все продукты р-ции, составляют отдельно р-ции ок
ния и восст-ия, γ суммируются в сокращённое ионно-молекулярное ур-ние.
H2S-2 =S+2H+ 5
+
MnO4-+8H++5 =Mn+2+4H2O 2
5 H2S+2 MnO4+16H=5S+10H+2Mn++8H2O
+
3SO4-2+K+ 2K++SO4-
8.5. Зависимость ок-но-восст-ых св-в от степени окисления Соединения высшей степени окисления, присущей данному эл-ту, м. в ок-но-восст-ых р-ях выступать только в качестве ок-лей, СО эл-та м.в этом случае только понежатся. Соединения низшей СО м.б., наоборот, только восст-ми; здесь СО эл-та м. только повышаться. Если эл-т находится в промежуточной СО, то его атома м. в зависимости от условий, как принимать, так и отдавать электроны. В первом случае СО эл-та будет понижаться, во втором – повышаться. Поэтому соединения, содержащие эл-ты в промежуточной СО, обладают ок-но - восст-ной двойственностью – способностью вступать в р-ции как с ок-ми, так и восст-ми.
3S0+6KOH=K2S+4O3+2K2S-2+H2O
S0-4 = S+4 1 ок-ся, в-ль
S0+2 = S-2 2 в-ся, ок-ль
