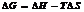Поляризация и поляризуемость ионов.
Неполное разделение зарядов в ионных соединениях м. объяснить поляризацией ионов, т.е. влиянием их друг на друга,γ приводит к деформации электронных оболочек ионов. Причиной поляризации всегда служит действие электрического поля. Каждый ион, будучи носителем электрического заряда, я-я источником электрического поля. Поэтому, взаимодействуя, противоположено заряженные ионы поляризуют друг друга. Поляризуемость различ. ионов неодинакова: чем слабее связаны внешние электроны с ядром, тем легче поляризуетсяион, тем сильнее он деформируется в электрическом поле. У ионов одинакового заряда, обладающих аналогичным строением внешнего электронного слоя, поляризуемость возрастает с увеличением размеров иона, т.к. внешние электроны удаляются всё дальше от ядра.
4.13 Межмолекулярное взаимодействие. Ориентационная составляющая связана с полярностью молекул.Молекула, обладающая дипольным моментом, притягивает другую полярную молекулу за счет электростатических сил диполь-дипольного взаимодействия (например, в жидком сероводороде). Молекулы при этом стремятся расположиться либо последовательно, либо антипараллельно: Такой ориентации препятствует тепловое движение молекул, усиливающееся с повышением температуры. Поэтому ориентационное взаимодействие тем больше, чем больше дипольные моменты, меньше расстояние между молекулами и ниже температура. Индукционнаясоставляющая возникает при взаимодействии полярной и неполярноймолекул, например, НС1 и Сl2 При этом полярная молекула поляризует неполярную, в которой появляется (индуцируется) наведенный дипольный момент. В результате возникает диполь-дипольное притяжение молекул. Энергия индукционного взаимодействия тем больше, чем больше дипольный момент полярной молекулы и чем больше поляризуемость неполярной. Поляризуемость молекул - - это мера смещения зарядов в молекуле в электрическом поле заданной напряженности. Поляризуемость резко увеличивается с увеличением размеров электронной оболочки. Например, в ряду молекул НС1, НВг и HI дипольный момент уменьшается, однако температуры плавления и кипения веществ увеличиваются, что связано с увеличением поляризуемости молекул.
Если две молекулы имеют постоянные дипольные моменты и обладают поляризуемостями то средняя потенциальная энергия их взаимодействия может быть оценена по формуле, полученной П. Дебаем. Ориентационные и индукционные силы между двумя молекулами зависят от присутствия других полярных молекул и, следовательно, не аддитивны. Дисперсионная составляющаяпритяжения молекулуниверсальна и п рисут-ствует всегда. Наиболее отчетливо дисперсионное притяжение проявляется при взаимодействии неполярных молекул и взаимодействии атомов благородных газов. Эти силы сравнимы по величине с силами полярных межмолекулярных взаимодействий. Суть возникновения дисперсионных сил заключается в следующем. При движении электронов в молекуле мгновенно возникает асимметрия распределения положительных и отрицательных зарядов. В результате такого движения электронов каждую молекулу можно рассматривать как место возникновения мгновенно существующих диполей различной направленности» Время существования такого осциллирующего диполя около 10-8 с. Попеременно возникающие диполи разных молекул в результате движения электронов ориентируются так, что возникает либо притяжение, либо отталкивание молекул.
4.14 Водородная связь Водородной связью называется способностью атома водорода, соединенного с атомом сильно электроотрицательпого элемента, к образованию еще одной химической связи с другим подобным атомом. Условием образования водородной связи является высокая электроотрицательность атома, непосредственно связанного в молекуле сатомом водорода.
4.15 Металлическая связьхарактеризуется слабым взаимодействием общих электронов с ядрами соединяемых атомов и полной делокализацией этих электронов между всеми атомами в кристалле, что обеспечивает устойчивость данной связи.
Металлы имеют особую кристаллическую решетку, в узлах которой находятся как атомы, так и катионы металлов, а между ними свободно перемещаются обобществленные электроны («электронный газ»). Движение общих электронов в металлах осуществляется по множеству молекулярных орбиталей, возникших за счет слияния большого числа свободных атомных орбиталей соединяемых атомов и охватывающих множество атомных ядер. Поэтому в случае металлической связи невозможно говорить о направленности этой связи.
5.1. Термохимией наз-ся раздел химии, занимающийся изучением тепловых эффектов хим. р-ций. Тепловые эффекты хим. процессов вызывается тем, что протекание р-ции сопровожд. разрывом одних хим. связей и обр-нием др. Разность энергий образующихся связей и тех, γ претерпели разрыв проявл-я в виде результирующего теплового эффекта хим. р-ций.
5.2. Термохимич. ур-ния.
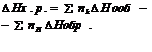
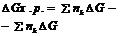 (Н.У)
(Н.У)
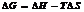
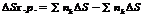
Экзо- и эндотермич. р-ции.
Разность энергий образующихся связей и тех, γ претерпели разрыв проявл-я в виде результирующего теплового эффекта хим. р-ций.
Хим. р-ции, сопровождающиеся выделение тепла наз-ся экзотермическими, р-ции
сопровождающиеся поглащением тепла – эндотермическими. В ходе экзотермич. процессов система теряет тепло, поэтому в экзотермич. р-ях тепловой эффект со знаком (-), в эндотермич. – со знаком (+)
5.4. Теплота образования.
Разность энергий образующихся связей и тех, γ претерпели разрыв проявл-я в виде результирующего теплового эффекта хим. р-ций. Тепловой эффект, соответствующий образованию 1 моля в-ва из устойчивых стандартных условий простых в-в наз-ся теплотой образования данного в-ва. При образовании хим. соединений поглащается или выделяется такое кол-во теплоты, какое выделяется ли поглащается при его разложении на первоначальные составные части.
Энтальпия.
Разность энергий образующихся связей и тех, γ претерпели разрыв проявл-я в виде результирующего теплового эффекта хим. р-ций.
Тепловой эффект хим. р-ций показывает изменение теплосодержания системы и наз-ся энтальпией (Н). Энтальпия простых в-в=0.
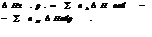
5.6. Закон Гесса.
Важнейшим законом, лежащим в основе термодинамич
вычислений я-я закон Гесса (или закон суммы тепловых эффектов). Этот закон утверждает, что тепловой эффект хим. р-ции зависит не от его пути, а от начального и конечного состояния.
1.С+О2=С О2
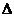 Н=-393,5 кдж/моль
Н=-393,5 кдж/моль 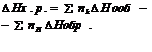
5.7. Энтропия (S)харак-ет возможное состояние в-ва и их постоянные изменения. Любому состоянию в-ва, взятому при опр. условиях отвечает большое разнообразие микросостояний. Это обусловлено тем, что частицы в-ва находятся в непрерывном колебательном движении, переходя из одного состояния в др. Энтропияотносят к 1 молю в-ва. Значение энтропии будет зависить от агрегатног состояния в-ва
Sг>>Sж>>Sт S измеряется в энтропийных единицах, Дж/моль*град. Значение энтропии зависит и от аллотропной модификации в-ва Sал=2,58 э.е.
Sгф=5,73 э.е. Значение энтропии зависит от сложности молекул Sco2>Sco на 16,2 э.е.
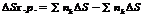
Энергия Гиббса.
Движущая сила хим. р-ции опр-ся изменением свободной энергией системы, т.е.
той части её общего теплосодержания, γ м.б. исп-на для совершения макс-ной работы, еёё опр-ют при постоянных температуре и давлении и наз-ют энергией Гиббса (G)
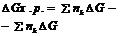 (Н.У)
(Н.У)