Электронное строение атома углерода. Гибридизация.
Для валентного электронного слоя атома С, находящегося вглавной подгруппе четвёртой группы второго периода Периодической таблицы Д. И. Менделеева главное квантовое число n = 2, побочное (орбитальное) квантовое число l = 0 (s-орбиталь) и 1 (р-орбиталь); магнитное квантовое число m = 0 (при l = 0) и –1, 0, 1 (при l = 1).
Для того, чтобы привести в соответствие электронную формулу атома С и его валентность, допускают возбуждение внешнего электронного слоя атома углерода. Тогда в атоме С 1s-орбиталь и 3р-орбитали. При перекрывании атомных орбиталей (АО) атомов С и Н три связи С–Н будут одинаковыми, а 4-я должна отличаться по прочности (связь по s- орбитали должна быть менее прочной из-за меньшего перекрывания орбиталей). В действительности это не так. Несоответствие исключается предположением о гибридизации различающихся по форме и энергии АО с появлением гибридных АО. В результате валентные электроны оказываются не на чистых s- и р- орбиталях, а на одинаковых гибридных. Для алканов характерна sр3- гибридизация (участвуют все 4 АО внешнего электронного уровня). В непредельных соединениях одна или две негибридизованные р-орбитали участвуют в образовании p-связей, при этом тип гибридизации атома углерода – sр2 для алкенов и sр для алкинов.
Гибридные орбитали алканов располагаются в пространстве симметрично и направлены к вершинам тетраэдра. Связь С–Н образуется перекрыванием s-орбитали атома Н и гибридизованной орбитали атома С, связь С–С образуется за счет перекрывания 2-х гибридизованных орбиталей (направление связи – по оси между атомами). Это s- связь.
Свойства s-связи:
- относительная химическая инертность вследствие высокой прочности;
- максимум электронной плотности расположен симметрично относительно оси, соединяющей атомы, поэтому возможно свободное вращение вдоль этой оси без изменения перекрывания орбиталей (конформеры);
- длина связи 0,154 нм; угол между направлениями орбиталей 109,5°;
- электроотрицательность атома С в sр3-гибридном состоянии = 2,51;
Атом углерода, связанный двойной связью с другим атомом углерода, находится в состоянии sр2-гибридизации. (участвуют 3 АО внешнего электронного уровня). Гибридные орбитали располагаются в пространстве симметрично в одной плоскости, содержащей ядра С. Оставшаяся негибридизированная р-АО ориентирована перпендикулярно этой плоскости. Связь С–Н образуется перекрыванием s-орбитали атома Н и гибридизованной орбитали атома С. Связь С–С образуется за счет перекрывания 2-х гибридизованных орбиталей (направление – по оси между атомами, в плоскости молекулы). Это s-связь. Две негибридизованные р-АО перекрываются выше и ниже плоскости молекулы – образуется p-связь.
Отличие двойной связи от одинарной:
- расстояние между атомами углерода при двойной связи меньше, чем при одинарной (0,134 нм); угол между гибридными АО 120°;
- электроотрицательность гибридизованного атома С = 2,69;
- затрудненное вращение вокруг линии, соединяющей атомы С;
- двойная связь более прочна, т.к. увеличивается электронная плотность на связывающих МО между атомами углерода (термическая стойкость этилена выше, чем этана);
- высокая реакционная способность p-связи, что объясняется большей подвижностью электронов вне плоскости молекулы;
- повышенная электронная плотность по сравнению с одинарной связью, причем на периферии молекулы. Это приводит к тому, что к двойной связи притягиваются положительно заряженные ионы или полярные молекулы своим положительным полюсом.
Связи С–Н в ацетилене относятся к числу s-связей, образованных путем перекрывания s-орбитали водорода с гибридизованной sp-орбиталью углерода; в молекуле имеется одна углерод-углеродная s-связь (образованная перекрыванием двух гибридизованных sp-орбиталей углерода) и две углерод-углеродные p-связи (результат перекрывания двух взаимно перпендикулярных пар негибридизованных р-орбиталей (ру и рz)атомов углерода).
Свойства тройной связи:
- атомы углерода, связанные тройной связью, имеют электроотрицательность = 2,75;
- длина СºС-связи = 0,120 нм;
- валентные углы в ацетилене на основании этой модели равны 180° и молекула имеет линейную конфигурацию, что делает невозможной цис-транс-изомерию при тройной связи;
- связь сильно поляризована, т.к. в sр- гибридной форме углеродный атом сильнее удерживает электроны, чем в sр2 и sр3 – гибридных формах; следовательно; электронная пара СН-связи в молекуле ацетилена ближе к ядру С, чем в случае этилена, атом Н более подвижен, обладает слабыми кислотными свойствами (в отличие от алканов и алкенов).
Сопряженные системы
Различают два типа сопряженных систем (и сопряжений).
 1. p, p-сопряжение — электроны делокализованы между двумя (и более) кратными связями. Например, в делокализации электронов в молекуле бутадиена участвуют четыре атома углерода: СН2=СН–СН=СН2 « СН2–¾СН–¾СН–¾СН2
1. p, p-сопряжение — электроны делокализованы между двумя (и более) кратными связями. Например, в делокализации электронов в молекуле бутадиена участвуют четыре атома углерода: СН2=СН–СН=СН2 « СН2–¾СН–¾СН–¾СН2
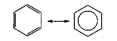 В молекуле бензола делокализация происходит с участием 6 атомов углерода (три двойные связи, каждую образует 2 электрона, по одному от каждого атома):
В молекуле бензола делокализация происходит с участием 6 атомов углерода (три двойные связи, каждую образует 2 электрона, по одному от каждого атома):
Кроме того, при осуществлении «кругового» сопряжения, как в бензоле, система получает дополнительный существенный выигрыш энергии, называемый энергией сопряжения. Например, энергия сопряжения молекулы бензола равна 15 кДж/моль.
2. р, p-сопряжение — в делокализации принимают участие электроны p-связи и р-орбитали гетероатома; например, в молекулах ацетамида и пиррола:
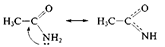 | 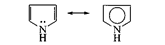 | ||
В случае молекулы ацетамида в делокализации участвуют три атома (С, О, N); в случае молекулы пиррола — пять атомов (4 атома С и атом N). Чем длиннее система сопряжения, тем более она устойчива. Ароматическая система представляет собой устойчивую плоскую циклическую сопряженную полиеновую структуру, содержащую (4п + 2) p-электронов (п = 1, 2, 3, ...). Например, бензол – ароматическая структура (6 p-электронов), а 1,3,5,7-циклооктатетраен – нет (8 p-электронов).
Делокализация электронов является одним из важных факторов повышения устойчивости молекул и ионов, поэтому это явление широко распространено в биологически важных молекулах (витамины, гем, хлорофилл, гемоглобин и др.).
Витамин А относится к сесквитерпенам (терпены – 10 углеродов и 3 дв. связи), содержится в масле, молоке, яичном желтке, рыбьем жире; свиное сало и маргарин его не содержат. Это витамин роста; недостаток его в пище вызывает убыль в весе, высыхание роговицы глаз, понижение сопротивляемости к инфекции. Витамин А заменяют каротином (тритерпен) С40Н56, (пигмент моркови); в организме человека каротин превращается в витамин А.

 Н3С
Н3С




 Н3С СН3 СН3 СН3
Н3С СН3 СН3 СН3

 СН=СН–С=СН–СН=СН–С=СН–СН=СН–СН=С–СН=СН–СН=С–СН=СН–
СН=СН–С=СН–СН=СН–С=СН–СН=СН–СН=С–СН=СН–СН=С–СН=СН–
СН3 СН3
СН3 b-каротин Н3С СН3


 Н3С СН3 СН3 СН3
Н3С СН3 СН3 СН3
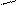 СН=СН–С=СН–СН=СН–С=СН–СН2 – ОН
СН=СН–С=СН–СН=СН–С=СН–СН2 – ОН
СН3 витамин А
В молекуле хлорофилла также присутствует развитая система сопряжённых связей – 4 остатка пиррола, образующих вместе порфириновое ядро, связанное с атомом магния. Хлорофилл — сложный эфир двухосновной кислоты и спиртов — метанола и фитола С20Н39ОН. По строению он близок к дыхательным ферментам (каталазе, пероксидазе) и к красящему веществу крови — гему.
Классификация органических соединений основана на анализе двух аспектов строения молекул – строения углеродного скелета и наличия функциональных групп.
 |
Рис. 1. Классификация органических соединений по строению углеродного скелета
Примеры алифатических углеводородов:
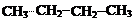 | |||||
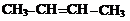 | 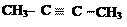 | ||||
предельные непредельные
алкан алкен (двойная связь) алкин (тройная связь)
Примеры 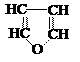
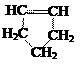
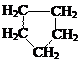 циклических углеводородов:
циклических углеводородов:
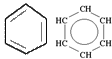 | |||
 | |||
карбоциклические гетероциклические
предельное непредельное ароматическое непредельное ароматическое
Ряд сходных по строению соединений, обладающих близкими химическими свойствами, в котором отдельные члены ряда отличаются друг от друга лишь количеством групп –СН2–, называется гомологическим рядом, а группа –СН2– гомологической разностью.
Для любого гомологического ряда может быть выведена общая формула. Так, СпН2п+2 – формула алканов, СпН2п+1ОН – алифатических одноатомных спиртов.
Таблица 1. Классы производных углеводородов по наличию функциональных групп
| Функциональная группа | Класс | Пример |
| атомы галогенов (F, Cl, Br, I) | галогенопроизводные | СН3СН2Cl (хлорэтан) |
| гидроксильная (–ОН) | спирты (фенолы) | СН3СН2ОН (этанол, первичный спирт) СН3СН(ОН)СН3 (2-пропанол, вторичный спирт) |
| тиольная или меркапто- (–SН) | тиолы (меркаптаны) | СН3СН2SН (этантиол) |
| эфирная (–О–) | простые эфиры | СН3СН2–О–СН2СН3 (диэтиловый эфир) |
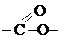 сложноэфирная сложноэфирная | сложные эфиры | СН3СН2СООСН3 (метиловый эфир уксусной кислоты или метилацетат) |
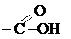 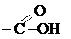 карбоксильная карбоксильная | карбоновые кислоты | 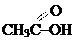 (уксусная кислота) (уксусная кислота) |
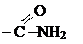 амидная амидная | амиды карбоновых кислот | 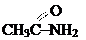 (амид уксусной кислоты или ацетамид) (амид уксусной кислоты или ацетамид) |
| карбонильная (–С=О) | альдегиды и кетоны | 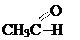 СН3СОСН3 (этаналь) (пропанон) СН3СОСН3 (этаналь) (пропанон) |
| сульфо- (–SО3Н) | сульфокислоты | СН3SО3Н (метансульфокислота) |
| амино- (–NH2) | амины | СН3СН2NH2 (этиламин, первичный амин) СН3NHСН3 (диметиламин, вторичный амин) |
| нитро- (–NO2) | нитросоединения | СН3СН2NО2 (нитроэтан) |
Атомы углерода, непосредственно соединенные с одним другим углеродным атомом называются первичными, соединенные с двумя атомами углерода – вторичными, с тремя другими атомами углерода – третичными, с четырьмя атомами С – четвертичными.
Номенклатура органических соединений: тривиальная, рациональная и систематическая номенклатура. Тривиальная номенклатура – совокупность исторически сложившихся названий. Так, по названию сразу понятно, откуда были выделены яблочная, янтарная или лимонная кислота, каким способом была получена пировиноградная кислота (пиролиз виноградной кислоты), знатоки греческого языка легко догадаются, что уксусная кислота – это что-то кислое, а глицерин – сладкое. Но название не отражает строение вещества.
Рациональная номенклатура строит название соединения на основании структуры более простого соединения (первого члена гомологического ряда). СН3ОН – карбинол, СН3СН2ОН – метилкарбинол, СН3СН(ОН)СН3 – диметилкарбинол и т.д.
По номенклатуре IUPAC (международная номенклатура), названия углеводородов и их функциональных производных базируются на названии соответствующего углеводорода с добавлением префиксов и суффиксов, присущих данному гомологическому ряду.
Алгоритм создания названия органического соединения:
1) выбрать в качестве основного углеродного скелета наиболее длинную последовательность углеродных атомов и назвать, обращая внимание на степень ненасыщенности соединения;
2) выявить все имеющиеся в соединении функциональные группы;
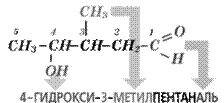 3) установить, какая группа является старшей (см. табл. 2), название этой группы отражается в названии соединения в виде суфикса и его ставят в конце названия соединения; все остальные группы дают в названии в виде приставок.
3) установить, какая группа является старшей (см. табл. 2), название этой группы отражается в названии соединения в виде суфикса и его ставят в конце названия соединения; все остальные группы дают в названии в виде приставок.
4) пронумеровать углеродные атомы основной
цепи, начиная со старшей группы;
5) перечислить приставки в алфавитном порядке
(умножающие добавки ди-, три- и т.д. не учитываются);
6) составить полное название соединения.
Начинать строить название соединения надо с названия родоначальной структуры, для чего абсолютно необходимо знать наизусть названия первых 10 членов гомологического ряда алканов (метан, этан, пропан, бутан, пентан, гексан, гептан, октан, нонан, декан). Также надо знать названия образующихся из них радикалов – при этом окончание –ан меняется на –ил.
Таблица 2. Номенклатура органических соединений
| Класс соединений | Функциональная группа | Приставка | Суффикс или окончание |
| карбоновые кислоты | - СООН | карбокси- | -овая кислота |
| сульфокислоты | – SO3H | cульфо- | сульфоновая кислота |
| нитрилы | – C º N | циан- | - нитрил |
| альдегиды | - СНО | оксо- | -аль |
| кетоны | – С = О | оксо- | -он |
| спирты | - ОН | гидрокси- | -ол |
| тиолы | – SH | меркапто- | -тиол |
| амины | - NН2 | амино- | -амин |
| алкены | – С = С – | - | -ен |
| алкины | - С ≡ С - | - | -ин |
| галогенопроизводные | -Br, -I, -F, -Cl | бром-, иод-, фтор-, хлор- | -бромид, -иодид, -фторид, -хлорид |
| нитросоединения | -NO2 | нитро- | - |
| углеводородные радикалы | СН3 – СН3СН2 – СН3СН2СН2 –  СН3СН – СН3 СН3СН – СН3 | метил- этил- пропил- изопропил- | – – – – |
В названиях спиртов, альдегидов, кетонов, карбоновых кислот, амидов, нитрилов, галогенангидридов суффикс, определяющий класс, следует за суффиксом степени ненасыщенности: например, 2-бутеналь. Соединения, содержащие другие функциональные группы, называются как производные углеводородов, например, 1-хлорпропан.
Названия кислотных функциональных групп помещают после названия углеводородного скелета: например, бензолсульфокислота.
Эфиры карбоновых кислот называются как производные родоначальных кислот. Окончание –овая кислота заменяется на –оат: например, метилпропионат – метиловый эфир пропановой кислоты.
Рассмотрим соединение, входящее в состав препаратов, применяемых для лечения заболеваний глаз: СН3 – С(СН3) = СН – СН2 – СН2 – С(СН3) = СН – СНО
Основная родоначальная структура – цепь из 8 атомов углерода, включающая альдегидную группу и обе двойные связи. Восемь атомов углерода – октан. Но есть 2 двойные связи – между вторым и третьим атомами и между шестым и седьмым. Одна двойная связь – окончание –ан надо заместить на –ен, двойных связей 2, значит на –диен, т.е. октадиен, а в начале указываем их положение, называя атомы с меньшими номерами – 2,6-октадиен. Но в соединении есть альдегидная группа, это не углеводород, а альдегид, поэтому добавляем суффикс –аль, без номера, он всегда первый – 2,6-октадиеналь. Ещё 2 заместителя – метильные радикалы у 3-го и 7-го атомов. Значит, в итоге получим: 3,7-диметил - 2,6-октадиеналь.
