Титриметрический метод анализа
Общие положения титриметрического метода. В производственной, природоохранной, научной деятельности постоянно приходится выяснять состав того или иного продукта, сырья, природного или искусственного материала. Эти задачи решаются методами аналитической химии. При этом может осуществляться качественный анализ, когда достаточно установить наличие или отсутствие в анализируемой пробе определенных веществ, или количественный анализ, когда выясняют, какие вещества и в каком количестве входят в состав (в виде основного компонента или как примеси) анализируемой пробы.
Одним из наиболее распространенных и точных методов количественного химического анализа является титриметрический метод анализа. Такое название указывает, что при осуществлении метода производят процесс титрования, заключающийся в постепенном прибавлении одного раствора к определённому объему другого раствора. При этом используется то очевидное обстоятельство, что реакция между двумя веществами протекает до тех пор, пока одно из них не будет израсходовано. По уравнению реакции можно рассчитать количество одного из реагентов, если известно, сколько вступило в реакцию другого реагента.
Титриметрический метод количественного анализа основан на точном измерении объемов растворов реагирующих веществ, концентрация одного из которых точно известна (растворы с известной концентрацией называются стандартными*). Определённый объем одного раствора титруют другим раствором. Титрование прекращают, когда вещество в титруемом растворе расходуется полностью в результате происходящей реакции. Этот момент называется точкой эквивалентности и соответствует тому, что количество вещества (число моль) в добавленном растворе (титранте) становится эквивалентным количеству вещества, содержавшемуся в титруемом растворе (момент достижения точки эквивалентности определяют по изменению окраски индикатора — об индикаторах см. далее).
Техника выполнения титрования. Индикаторы. Для прибавления титранта к титруемому раствору используют бюретку — стеклянную узкую и длинную трубку, на которой нанесена градуировка десятых долей миллилитра (см рис. на первой странице обложки). Выпускное устройство снизу бюретки позволяет точно регулировать скорость добавления титранта (от струи до отдельных капель) и точно измерять объем добавленного титранта. В лабораторной практике пользуются обычно бюретками на 25 мл.
Определенное количество титруемого раствора (в большинстве случаев это исследуемый раствор) отмеряют и переносят в коническую колбу. Туда же вливают несколько капель раствора индикатора. К раствору в колбе постепенно добавляют из бюретки титрант (в большинстве случаев и в опытах, выполняемых в данной работе, (но не всегда!) титруемый раствор является исследуемым раствором, а титрант — стандартным). При достижении точки эквивалентности окраска индикатора меняется, титрование прекращают и измеряют по шкале бюретки объем добавленного титранта, значение которого затем используют для расчетов.
Окраска индикатора зависит от концентрации веществ, находящихся в растворе. Например, окраска индикаторов, применяемых в кислотно-осно́вном титровании (методе нейтрализации), зависит от концентрации ионов водорода в растворе:
| Индикатор | Цвет раствора | ||
| в кислой среде | переходная окраска | в щелочной среде | |
| Метиловый оранжевый | розовый | оранжевый | желтый |
| Фенолфталеин | бесцветный | красно-фиолетовый | красно-фиолетовый |
Если титровать щелочной раствор кислотой в присутствии метилового оранжевого, то окраска титруемого будет оставаться желтой вплоть до полной нейтрализации щелочного компонента, что и означает достижение точки эквивалентности; при этом индикатор меняет окраску с желтой на оранжевую. Если добавить хотя бы одну каплю избыточной кислоты, окраска становится красно-розовой. В таком случае говорят, что «раствор перетитрован». При этом измеренный по бюретке объем титранта больше, чем объем, в действительности необходимый для нейтрализации; это вносит ошибку в последующие расчеты.
В титрметрии, кроме метода нейтрализации, существуют и другие методы, в которых используются свои индикаторы, меняющие окраску в зависимости от присутствия каких-либо веществ в растворе.
Химический эквивалент и молярная концентрация эквивалента. Какие количества веществ являются эквивалентными друг другу, определяется уравнением реакции. Например, в реакции нейтрализации:
NaOH + HCl = NaCl + H2O
реагируют без остатка 1 моль щелочи и 1 моль кислоты. Но при взаимодействии гидроксида натрия с серной кислотой:
NaOH + ½H2SO4= ½Na2SO4 + H2O
на нейтрализацию 1 моля щелочи достаточно ½ моля серной кислоты. Принято считать, что один моль HCl (как и один моль NaOH) представляет собой один химический эквивалент. В то же время ½ моля серной кислоты также представляет один химический эквивалент. Отсюда следует, что соотношение, при котором вещества прореагируют друг с другом без остатка, надо вычислять не по числу молей этих веществ, а по числу их молей эквивалентов. Таким образом, для выражения содержания веществ в растворах, используемых в титриметрии, удобно использовать концентрацию (см. раздел общей химии «Способы выражения концентраций растворов»), показывающую, сколько молей эквивалента вещества находится в единице объема (одном литре) раствора. Это так называемая молярная концентрация эквивалента (Сн , моль экв/л). Ранее для этой концентрации использовалось название «нормальная концентрация» (единица измерения мг-экв/л), которое в настоящее время исключено из нормативных документов: ГОСТов, методик и т.п. Однако это старое название продолжает широко употребляться в практической работе. Соответственно, характеризуя значение Сн , по-прежнему говорят, что раствор имеет определенную нормальность; например, раствор с концентрацией 2 моль экв/л называют двунормальным, 1 моль экв/л — нормальным, 0,1 моль экв/л — децинормальным и обозначают соответственно 2 н., 1 н., 0,1 н. и т.д. В данном учебном пособии такие термины и обозначения также используются.
Понятие химического эквивалента позволяет учесть, что одна молекула вещества может быть в реакции равноценна двум, трем и даже большему числу молекул другого вещества. Химическим эквивалентом вещества называется такое количество (число моль) или масса этого вещества, которая в химических реакциях эквивалентна (т.е. присоединяет, замещает, выделяет) 1 моль (или 1 г) ионов водорода Н+ или атомарного водорода Н. Для кислот и оснований величина молярной массы химического эквивалента Mэкв, рассчитывается из молярной массы M с учетом числа ионов водорода, отщепляемых молекулой кислоты или числа гидроксид-ионов, отщепляемых молекулой основания при диссоциации:
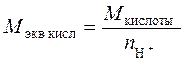 ;
; 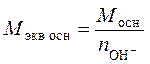 .
.
Таким образом, показывают, какая масса из общей массы моля вещества эквивалентна в реакции одному молю однозарядных ионов. Аналогично, при нахождении молярной массы химического эквивалента отдельного иона, молярную (или атомную) массу иона делят на его заряд z, вычисляя, какая масса приходится на единичный заряд:
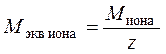 .
.
Расчет эквивалентной молярной массы ионов магния и кальция приведен в подразделе 1.1. при рассмотрении единиц измерения жёсткости.
Расчет концентрации анализируемого раствора. Очевидно, что чем больший объем стандартного раствора титранта Vстанд потрачен на достижение точки эквивалентности и чем больше концентрация этого титранта Cстанд (здесь и далее речь идет только о нормальной концентрации, поэтому индекс «н» в обозначении Cн можно опустить), тем больше концентрация Cx анализируемого титруемого раствора, т.е. при расчете оказывается, что
Cx ~ Cстанд·Vстанд . В то же время, титранта надо затратить тем больше, чем больше взято исходного титруемого раствора; чтобы это учесть, при расчете Cx произведение объема и концентрации затраченного титранта следует отнести к объему титруемого раствора Vx:
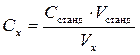 .
.
