Электролитическая диссоциация воды.
Водородный показатель
Тщательно очищенная химически чистая вода имеет весьма незначительную электропроводность, которая объясняется наличием ионов, способных переносить электричество. Вода характеризуется ионной проводимостью. Процесс диссоциации воды протекает в две стадии:
1) Образование водородных и гидроксид - ионов:
H2O  H+ + OH-
H+ + OH-
2) Гидратация водородного иона с образованием гидроксоний - иона:
H+ + H2O 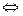 OH3+
OH3+
Первая стадия этого процесса эндотермична, а вторая сильно экзотермична, поэтому практически все ионы водорода гидратированы и электролитическую диссоциацию воды сле-
дует изображать следующим уравнением:
2 H2O  OH3++ OH-
OH3++ OH-
Возможно присоединение и большего числа молекул воды к H+, поэтому пользуются упрощенной формулой.
При 220 С степень электролитической диссоциации воды равна 1,8 ∙ 10-9, т.е. из 555 000 000 молекул воды диссоциирует только одна. Следовательно, вода является очень слабым электролитом и для описания процесса её электролитической диссоциации применим закон действия масс.
 или
или  или
или  ,
,
где  - константа диссоциации воды. Активности могут быть заменены их концентрациями
- константа диссоциации воды. Активности могут быть заменены их концентрациями
[OH3+] [OH-] =  [H2O]2
[H2O]2
Т.к. практически [H2O] = const, то окончательно имеем [OH3+] [OH-] = K 
Постоянная K  называется ионным произведением воды. Можно рассчитать эту величину для 22 0С. В 1 л воды, массой которого можно принять равной 1000 г, находится
называется ионным произведением воды. Можно рассчитать эту величину для 22 0С. В 1 л воды, массой которого можно принять равной 1000 г, находится  молей воды.
молей воды.
Следовательно, концентрация гидроксоний - ионов и гидроксид - ионов в воде равна
[OH3+] = [OH-] = 55,5∙ 1,8∙ 10-9 = 1∙ 10-7 г-ион/л
Отсюда значение ионного произведения воды будет
[OH3+] [OH-]=10-7∙ 10-7=10-14 при 22 0С.
Эта величина возрастает с повышением температуры.
Водородный показатель.В зависимости от содержания в водных растворах электролитов ионов OH3+ и OH- различают кислую, нейтральную и щелочную среды.
В соответствии с теорией электролитической диссоциации ионы OH3+ или упрощенно H+ являются носителями кислотных свойств, а ионы OH- - носителями основных свойств. Поэтому раствор будет нейтральным, когда [H+] = [OH-] =  ; кислым, когда [OH-] < [H+]; и щелочным, когда [OH-] > [H+].
; кислым, когда [OH-] < [H+]; и щелочным, когда [OH-] > [H+].
Для характеристики кислотности (щелочности) среды введен специальный параметр - водородный показатель или рН. Водородным показателем, или рН, называется взятый с обратным знаком десятичный логарифм активности (концентрации) водородных ионов в растворе: рН = -lg aн  или рН = - lg [H+]
или рН = - lg [H+]
Водородный показатель определяет характер реакции раствора:
Нейтральная среда [H+] = [OH-] = 10-7 г-ион/л рН = 7
Кислая среда [H+] > [OH-] > 10-7 г-ион/л рН < 7
Щелочная среда [H+] < [OH-] < 10-7 г-ион/л рН > 7
Величина рН имеет важное значение для понимания большинства процессов, протекающих в жидкой фазе, так как ионы H+ и OH- непосредственно участвуют во многих из этих процессов. Кроме того, эти ионы являются гомогенными катализаторами многих реакций. Величина рН может служить критерием силы кислоты или основания. В ряду кислот более сильной будет та, у которой при одинаковой молярной концентрации активность ионов H+ будет выше (величина рН ниже). Так, рН 0,1 м растворов уксусной и соляной кислот будут 2,87 и 1,088 соответственно. Для оснований подобная зависимость носит обратный характер.
В виду большого практического применения рН растворов в настоящее время разработаны различные способы опре-
деления водородного показателя. С помощью растворов индикаторов, индикаторной бумаги и более точные - инструментальные с помощью рН - литров.
Индикаторами называются вещества, изменяющие свою окраску в зависимости от концентрации водородных ионов или гидроксид - ионов.
По химической природе индикаторы являются или слабыми кислотами или слабыми основаниями. В качестве индикаторов применяют такие соединении, у которых молекулы или ионы имеют различную окраску.
Например, кислотный индикатор. Диссоциация кислотного индикатора HInd может быть представлена следующей схемой:
HInd 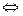 H++Ind-
H++Ind-
окраска 1 окраска 2
КHInd= 
С увеличением кислотности раствора (повышением [H+]) равновесие смещается влево, т.е. наблюдается переход окраски 2 в сторону образования окраски 1. Очевидно, чем резче отличаются эти окраски между собой и чем чувствительнее отзывается равновесие на изменение концентрации [H+], тем выше и чувствительность индикатора. Для каждого индикатора существует определенная область (интервал рН) перехода окраски (табл.1), которой может быть замечен визуально или с помощью приборов (колориметрический анализ).
Таблица 8
Индикаторы и интервалы рН перехода окраски.
| Индикатор | Характер индикатора | Значение рН области перехода окраски | Окраска |
| Метиловый оранжевый (метилоранж) Лакмус фенолфталеин | при малых рН | при больших рН | |
| основной кислотный щелочной | 3,1 - 4,4 6 - 8 8,3 - 9,8 | красная красная бесцветная | желтая синяя малиновая |
