Дайте полное решение заданий.
1. Составьте электронную формулу атомов железа, графически укажите валентные электроны в нормальном и возбужденном состояниях. Какие степени окисления может проявлять атом железа? Приведите примеры оксидов и гидроксидов железа в соответствующих степенях окисления, укажите их характер.
2. Если в момент химического равновесия 2NO + O2 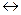 2NO2 концентрации NO, O2 и NO2 соответственно равны 8 моль/л., 6 моль/л., 4 моль/л., то начальные концентрации исходных веществ (NO и O2) были:
2NO2 концентрации NO, O2 и NO2 соответственно равны 8 моль/л., 6 моль/л., 4 моль/л., то начальные концентрации исходных веществ (NO и O2) были:
1) 12 моль/л и 8 моль/л;
2) 14 моль/л и 8 моль/л;
3) 16 моль/л и 12 моль/л;
4) 32 моль/л и 24 моль/л.
3. Окисление аммиака протекает по уравнению: 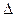 Н обр. 4NH3 + 3O2 = 2N2 + 6 H2O
Н обр. 4NH3 + 3O2 = 2N2 + 6 H2O 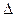 Н x.p. = -1528 кДж
Н x.p. = -1528 кДж
кДж/моль г г г ж (-285,84)
теплота образования аммиака ( 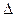 Н0 обр.(NH3)) равна:
Н0 обр.(NH3)) равна:
1) -92,15 кДж/моль;
2) 92,15 кДж/моль;
3) 46,76 кДж/моль;
4) -46,76 кДж/моль.
Реакция восстановления оксида меди (II) алюминием возможна
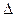 G0 обр. 3CuO + 2Al = Al2O3 + 3Cu
G0 обр. 3CuO + 2Al = Al2O3 + 3Cu
КДж/моль -129,8 -1582
свободная энергия Гиббса ( 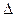 G х.р.) равна:
G х.р.) равна:
1) -1192 кДж;
2) -3576 кДж;
3) +1192 кДж;
4) +3576 кДж .
5. При взаимодействии 1 моль ортофосфорной кислоты с 1 моль гидроксидом натрия образуется:
1) ортофосфат натрия 3) дигидроортофосфат натрия
2) гидроортофосфат натрия 4) фосфат натрия
Составьте молекулярно-ионные уравнения реакций. Сумма всех коэффициентов в кратком ионном уравнении равна…
6. Метилоранж становится желтым при растворении в воде каждой из двух солей:
1) K2S и K3PO4 3) LiCl и FeSO4
2) KNO3 и K3PO4 4) CH3COOK и K2SO4
Составьте молекулярно-ионные уравнения реакций гидролиза.
7. При взаимодействии водных растворов солей сульфата алюминия и карбоната натрия, сумма коэффициентов в кратком ионном уравнении равна:
1) 10 2) 12 3) 13 4) 9
8. Кислая среда образуется при растворении в воде каждой из двух солей:
1) BaCl2 и AlCl3 3) CuCl2 и LiCl
2) K2S и K3PO4 4) NH4NO3 и Zn(NO3)2
Составьте молекулярно-ионные уравнения гидролиза, выведите константу гидролиза по первой ступени.
9. В уравнение реакции схема которой:
 FeSO4 + KMnO4 + H2SO4 Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
FeSO4 + KMnO4 + H2SO4 Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
Сумма коэффициентов перед формулами исходных веществ равна:
1) 20 3) 25
2) 18 4) 22
Дайте полное решение задания (используйте ионно-электронный метод).
10. Установите правильную последовательность действий при определении типа гибридизации Ц.А. в частице:
1. Определите тип гибридизации;
2. Вычислите ст. ок., Ц.А. и число неспаренных ( 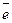 );
);
3. Найдите Ц.А. в частице;
4. Укажите К.Ч. (Ц.А.) и число 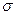 связей;
связей;
5. Графически изобразите валентные ( 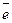 ) Ц.А. в соответствующей степени окисления.
) Ц.А. в соответствующей степени окисления.
6. Определите валентные электроны, участвующие в образовании связей в периферийных атомах и покажите их перекрывание с ГАО Ц.А.
7. Изобразите структурную формулу, указывающую геометрию частицы.
Установите соответствие:
Тип гибридизации Ц.А. Частица
1) sp2 a) Н2О
2) sp3 б) ВН3
3) sp3d в) SCl6
4) sp3d2 г) CO
5) sp д) PCl5
Рассмотрите по алгоритму те частицы, в которых Ц.А. в sp3 и sp3d гибридизации.
12. В Г.Э.: Ag | AgNO3 | | Fe(NO3)2 | Fe
| Электроды 1. Катод 2. Анод | Процессы а) Fe0 – 2e ® Fe2- б) Fe2- + 2e ® Fe0 в) Ag0 – 1e ® Ag- г) Ag- + 1e ® Ag0 |
Рассчитайте ЭДС при н.у.
