Укажите расчетную формулу и единицы измерения моляльной концентрации
1)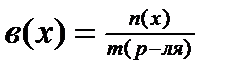 ;[моль/кг]
;[моль/кг]
2) 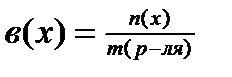 ; [моль/г]
; [моль/г]
3)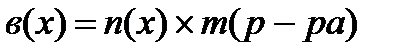 ;[моль×г]
;[моль×г]
4)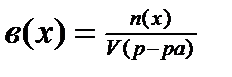 ;[моль/л]
;[моль/л]
Рассчитайте молярную концентрацию раствора, содержащего 117 г хлорида натрия
1) 2 моль/кг 2) 2,8 моль/л 3) 0,5 моль/кг 4) 2М
20 Эквивалент – это:
1) величина, соответствующая числу моль растворенного вещества
2) величина равная степени диссоциации
3) количество вещества, выпавшее в осадок
4) безразмерная величина равная основности кислоты; кислотности основания; для солей соответствует валентности металла, помноженное на количество его атомов; в окислительно-восстановительных реакций соответствует количеству электронов
21. Определите значение фактора эквивалентности для КMnO4 в кислой среде
1) 1/2 2) 3/4 3) 1/5 4) 1,5 моль
Рассчитать молярную массу эквивалента серной кислоты
1) 46 кг/моль 2) 98 г/моль 3) 49 г/моль 4) 98 %
23. Формула для расчета молярной доли компонента в растворе имеет вид:
1) 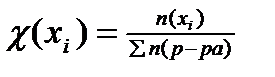 2)
2) 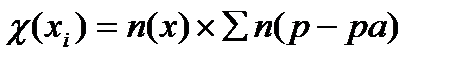 3)
3) 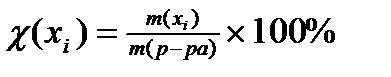 4)
4) 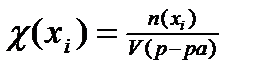
К метиловому спирту массой 32 г плотностью 0,8 г/мл добавили воду до объема 80 мл. Определите объемную долю спирта в растворе
1) 2% 2) 50% 3) 64 моль/л 4) 46 г/моль
Рассчитать молярную концентрацию эквивалента хлороводородной кислоты массой 73 г в 10 л раствора
1) 8% 2) 0,2 моль/л 3) 24 г/л 4) 0,46
При смешивании воды объемом 50 мл (плотностью 1 г/мл) и метилового спирта объемом 70 мл (плотностью 0,8 г/мл) получили раствор с плотностью 0,9 г/мл. Определите объемную долю метилового спирта в растворе
1) 47 моль/л 2) 68 моль/л 3) 59,4 % 4) 5,94 %
27. Какую массу медного купороса CuSO4×5H2O и воды надо взять для приготовления раствора сульфата меди (II) массой 40 кг с массовой долей CuSO4 2%?
1) 1,25 кг CuSO4×5H2O и 38,75 кг H2O 2) 100 кг CuSO4×5H2O и 56 кг H2O
3) 12 кг CuSO4×5H2O и 800 г H2O 4) 60 г CuSO4×5H2O и 1 кг H2O
Определите молярную концентрацию раствора, полученного при растворении сульфата натрия массой 42,6 г в воде массой 300 г, если плотность полученного раствора равна 1,12 г/мл
1) 0,98 моль/л 2) 0,98% 3) 41М 4) 0,74
29. Фактор эквивалентности для Al2(SO4)3 равен
1) 0,6 2) 6 3) 1/6 4) 6%
Вычислите, какая масса щавелевой кислоты содержится в 200 мл раствора, если титр его равен 0,0012607 г/мл
1) 0,25214 г 2) 0,4 мг 3) 0,25214 г 4) 4,8 г
Определите молярную концентрацию раствора с массовой долей гидроксида натрия 0,2 и плотностью 1,22 г/мл
1) 0,164 моль/л 2) 3М 3) 8% 4) 6,1 моль/л
32. Сокращенное молекулярно-ионное уравнение Ва+2+SO42-=BaSO4 соответствует реакции…
1) Ba(NO3)2+SO2® 2) BaCO3+H2SO4® 3) BaCl2+Na2SO4® 4) Ba3(PO4)2+H2SO4®
33. Полному гидролизу подвергаются соли…
1) CrCl3 2) Al2(SO4)3 3) Cr2S3 4) Cs2CO3
34. Нейтральную среду имеют растворы солей …
1) RbNO3 2) HCOOK 3) BaCl2 4) CsF
35. Кислую среду имеют растворы солей…
1) K2SiO3 2) AlCl3 3) (NH4)2SO4 4) CaCl2
36. При разбавлении раствора степень диссоциации слабого электролита…
1) увеличивается 2) уменьшается 3) не меняется 4) меняется неоднозначно
37. Сильными электролитами являются …
1) HI 2) CuSO4 3) NH4OH 4) Ca3(PO4)2
38. Отношение числа молекул, диссоциирующих на ионы, к общему числу молекул растворенного вещества, называется _____ диссоциации.
1) коэффициентом 2) степенью 3) показателем 4) константой
39. В водном растворе гидролизу не подвергаются соли…
1) K2SiO3 2) K2SO4 3) AlCl3 4) NaNO3
Среда водного раствора хлорида аммония
1) слабощелочная 2) кислая 3) нейтральная 4) сильнощелочная
