Некоторые типы многостадийных реакций
Среди многостадийных химических процессов можно выделить несколько групп реакций, представляющих особый интерес: это параллельные, последовательные, сопряженные и цепные реакции.
Параллельные реакции имеют одинаковые исходные вещества, но разные продукты взаимодействия. Так, например, при нагревании хлората калия (KClO3) одновременно протекают две реакции:
2KClO3 = 2KCl + 3O2 и 4KClO3 = 3KClO4 + KCl
Можно добиться преимущественного протекания одной из этих реакций. Так, при введении в систему катализатора MnО2 взаимодействие преимущественно протекает по первому уравнению. Однако и в этом случае образуются небольшие количества KClO4.
Последовательные реакции - это системы реакций, в которых каждый продукт предшествующей стадии является реагентом в последующей стадии. Последовательные реакции очень распространены. Так, например, при электрохимическом окислении хлорида калия до перхлората калия (KClO4), протекающем на аноде по суммарному уравнению:
Cl- + 4H2O – 8e- = ClO 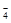 + 8H+
+ 8H+
промежуточными продуктами, подвергающимися последующему окислению, являются хлор и анионы ClO-, ClO 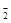 , ClO
, ClO 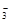 .
.
Сопряженными реакциями называются процессы, один из которых инициирует другой. Примером подобных реакций может служить окисление бромной кислотой (HBrO3) сернистой и мышьяковистой кислот при их совместном присутствии. H2SO3 и H3AsO3 окисляются до H2SO4 и H3AsO4. Бромная кислота окисляет H2SO3, но не окисляет H3AsO3; однако при действии HBrO3 на смесь этих кислот окисляются обе.
Цепные реакции - это сложные системы параллельных, последовательных и сопряженных реакций, в случае которых первичное активирование частицы приводит к превращению большого числа молекул.
Простейшим типом цепных реакций являются реакции с неразветвленными цепями. Эти цепные реакции включают стадии зарождения, продолжения и обрыва цепи. Рассмотрим неразветвленную цепную реакцию, протекающую при действии света на смесь водорода с хлором. Зарождением цепи в этом случае является реакция образования атомных радикалов хлора при поглощении молекулой хлора кванта лучистой энергии:
hν
Cl2 = 2Cl·
Продолжение цепи обеспечивается протеканием реакций:
H2 + Cl· = HCl + ·H;H·+ Cl2 = HCl + Cl·и т.д.
Обрыв цепи может произойти за счет образования молекул водорода и хлора из радикалов:
Н·+ Н·= Н2; Cl·+ Cl·= Cl2
Для обрыва цепи необходимо, чтобы какая-нибудь частица увела избыточную энергия от "горячих" молекул Н2 и Сl2. Это наблюдается, когда столкновение происходит на стенке сосуда или при столкновении "горячей молекулы" в момент ее образования с какой-нибудь частицей, которой может быть передана избыточная энергия. Средняя длина цепи зависит от природы реагирующих веществ. При фотосинтезе хлороводорода поглощение кванта лучистой энергии приводит к образованию нескольких десятков тысяч молекул хлороводорода.
Более сложным типом цепных реакций являются разветвленные процессы, включающие стадии, когда из одного радикала образуются два и более новых радикалов. Эта стадия называется разветвлением цепи. Примером подобного процесса может служить взаимодействие водорода с кислородом:
Н2 + О2 = ·ОН + ·ОН;
Н2 + ·ОН = Н2О + ·Н;
Н·+ О2 = ·ОН + ·О·
Н2 + ·О·= ·ОН + Н· и т.д.
Первая реакция соответствует зарождению цепи, вторая - продолжению цепи, третья и четвертая - разветвлению цепи. Подобные реакции обычно протекают лавинообразно и приводят к взрыву.
Химическое равновесие.
