Элементы IIIВ - VB подгрупп (подгруппы скандия,титана и ванадия)
26.1. Общая характеристика d-элементов
d-Элементами называют элементы, у которых происходит последовательное заполнение электронами d-орбиталей от (n-1)d1ns2- до (n-1)d10ns2-конфигурации. Иногда электронные структуры d-элементов видоизменяются из-за явления провала электрона, которое становится вероятным при приближении d-подуровня к полному или половинному заполнению (d10 или d5). Например, атом меди имеет конфигурацию 3d104s1 вместо ожидаемой 3d94s2, а атом молибдена имеет конфигурацию 4d55s1 вместо 4d45s2. У одного элемента периодической системы - палладия - наблюдается двойной провал электронов (4d105s0 вместо 4d85s2).
В зависимости от энергетического уровня, d-орбитали которого подлежат заполнению, различают четыре ряда d-элементов:
3d-элементы (от Sc до Zn); 4d-элементы (от Y до Cd); 5d-элементы (от La до Hg)
Часто наряду с понятием d-элементы используют термин "переходные элементы" или "переходные металлы". Переходными называются элементы, которые хотя бы в одной степени окисления имеют незавершенный d-подуровень. Таким образом, элементы с конфигурацией
(n-1)d10ns2 (цинк, кадмий, ртуть), завершающие ряды d-элементов, переходными не являются.
Особенностью электронной оболочки d-элементов является наличие на внешнем уровне одного или двух электронов, поэтому все d-элементы являются металлами. В то же время доступность d-электронов приводит к тому, что наряду со степенями окисления +1 и +2 переходные элементы проявляют и более высокие степени окисления, вплоть до +8. Проявляя высшие степени окисления, переходные металлы образуют соединения, подобные соединениям типических (непереходных) элементов, например:
SVI SO3 H2SO4 K2SO4
CrVI CrO3 H2CrO4 K2CrO4
кислотные оксиды сильные кислоты
Наличие энергетически доступных d-орбиталей позволяет d-элементам образовывать устойчивые и разнообразные по составу, строению и свойствам координационные соединения. При этом d-металлы могут проявлять различные координационные числа, чаще всего 4 и 6. Наиболее часто встречаются следующие типы гибридизации и геометрии координационного полиэдра:
| Координационное число | Тип гибридизации | Геометрия |
| sp3 | тетраэдр | |
| dsp2 | квадрат | |
| sp3d | тригональная бипирамида, тетрагональная пирамида | |
| sp3d2 | октаэдр, тетрагональная бипирамида |
У d-металлов с увеличением порядкового номера происходит заполнение предвнешнего электронного уровня, поэтому изменения их физических и химических свойств не столь заметны как в ряду типических элементов. Незначительно меняются свойства d-металлов и в пределах подгрупп. Особенно близки по свойствам элементы V и VI периодов, что вызвано близостью их эффективных атомных радиусов за счет лантаноидного сжатия, например:
| Элемент | V | Nb | Ta |
| Радиус, нм | 0,134 | 0,146 | 0,146 |
26.2. Элементы IIIВ подгруппы (подгруппы скандия)
IIIВ-подгруппа (скандий - Sc, иттрий - Y, лантан - La и радиоактивный актиний - Ac) включает элементы с общей электронной формулой (n-1)d1ns2. Наличие на d-подуровне единственного электрона, обуславливает повышенную активность данных элементов (по химической активности они уступают только щелочным и щелочноземельным металлам) и образование ими соединений в степени окисления +3. При повышенных температурах они реагируют практически со всеми неметаллами, исключая инертные газы. Растворяются в водных растворах кислот. Разбавленную азотную кислоту восстанавливают до нитрата аммония:
8Sc + 30HNO3(разб) = 8Sc(NO3)3 + 3NH4NO3 + 9H2O
Лантан уже при обычных условиях медленно реагирует с водой:
2La + 6H2O = 2La(OH)3 + 3H2
Оксиды - Э2О3 - белые тугоплавкие вещества, основные оксиды. Оксид лантана реагирует с водой:
La2O3 + 3H2O = 2La(OH)3
В ряду гидроксидов увеличивается растворимость в воде и усиливаются основные признаки. Sc(OH)3 амфотерен, а La(OH)3 - сильное основание, растворимое в воде (щелочь). Галогениды и соли скандия, иттрия, лантана напоминают по свойствам галогениды и соли алюминия.
Скандий, иттрий и лантан рассеянные элементы, самостоятельных рудных месторождений не образуют. Получают их электролизом хлоридов в расплавах.
26.3. Элементы IVВ подгруппы (подгруппы титана)
Элементы IVB-подгруппы (титан - Ti, цирконий - Zr, гафний - Hf и курчатовий - Ku) полные электронные аналоги с общей электронной формулой (n-1)d2ns2.
Титан - довольно распространенный элемент (кларк равен 0,25 мол.%), основные минералы: рутил - TiO2, ильменит - FeTiO3, перовскит - CaTiO3. Цирконий и гафний - рассеянные элементы. Основные минералы циркония: циркон - ZrSiO4 и баддалеит - ZrO2.
Простые вещества титан, цирконий и гафний - серебристо-белые тугоплавкие и прочные металлы, хорошо поддающиеся механической обработке. Титан легкий металл (4,5 г/см3), цирконий и гафний - металлы тяжелые .
При обычных условиях титан, цирконий и гафний устойчивы. При нагревании горят в атмосфере кислорода, образуя оксиды ЭО2, реагируют с азотом (ЭN) и галогенами (ЭHal4). Титан при нагревании растворяется в соляной кислоте:
t
2Ti + 6HCl = 2TiCl3 + 3H2
Цирконий и гафний растворяются в кислотах, образуя устойчивые координационные соединения. Например, в плавиковой и концентрированной серной кислотах:
Zr + 6HF = H2[ZrF6] + 2H2
Zr + 5H2SO4 = H2[Zr(SO4)3] + 2SO2 + 4H2O
К растворам щелочей цирконий и гафний (в меньшей степени титан) устойчивы.
Металлы подгруппы титана получают в промышленности металлотермическими методами:
t
TiCl4 + 2Mg = 2MgCl2 + Ti
t
K2[ZrF6] + 4Na = 4NaF + 2KF + Zr
Титан ввиду его прочности и легкости широко используется в самолетостроении и кораблестроении, из него изготавливают корпуса подводных лодок. Цирконий и в меньшей мере гафний используются как конструкционные материалы в атомной энергетике.
Цирконий и гафний образуют соединения в степени окисления +4, титан кроме этого способен образовывать соединения в степени окисления +3.
Для титана и его аналогов известны тетрагалогениды, диоксиды и гидроксиды, а также дисульфиды. Гидриды (ЭН2), карбиды (ЭС), нитриды (ЭN), силициды (ЭSi2) и бориды (ЭВ, ЭВ2) - соединения переменного состава. Хлориды, бромиды и иодиды Ti(IV), Zr(IV) и Hf(IV) имеют молекулярное строение, летучи и реакционноспособны, легко гидролизуются. Иодиды при нагревании разлагаются с образованием металлов, что используется при получении титана, циркония и гафния высокой степени чистоты:
t
TiI4 = Ti + 2I2
Тетрафториды титана, циркония и гафния полимерны и малореакционноспособны.
Диоксиды титана, циркония и гафния тугоплавкие, химически довольно инертные вещества. Проявляют свойства амфотерных оксидов: медленно реагируют с кислотами при длительном кипячении и взаимодействуют со щелочами при сплавлении:
t
TiO2 + 2H2SO4 = Ti(SO4)2 + 2H2O
t
TiO2 + 2NaOH = Na2TiO3 + H2O
Гидроксиды титана(IV), циркония(IV) и гафния(IV) - аморфные соединения переменного состава - ЭО2×nН2О. Свежеполученные вещества довольно реакционноспособны и растворяются в кислотах, гидроксид титана растворим и в щелочах. Состарившиеся осадки крайне инертны.
Соли элементов подгруппы титана в степени окисления +4 немногочисленны и гидролитически неустойчивы. Описано большое число анионных комплексов титана, циркония и гафния.
Соединения титана(III): оксид, хлорид, соли Ti3+ - сильные восстановители:
4TiCl3 + O2 + 2H2O = 4TiOCl2 + 4HCl
26.4. Элементы VВ подгруппы (подгруппы ванадия)
Подгруппа VB включает следующие элементы: ванадий - V, ниобий - Nb, тантал - Ta. Общая электронная формула: (n-1)d3ns2. У ниобия наблюдается провал электрона с образованием конфигурации 4d45s1. Ванадий распространенный элемент, его кларк равен 0,006 мол.%. Основные минералы: патронит VS2-2,5, ванадинит Pb5(VO4)3Cl. Ниобий и тантал - редкие и рассеянные элементы, обычно встречаются вместе, образуя минерал состава (Fe,Mn)(ЭО3)2 (при преобладающем содержании ниобия - колумбит, при большем содержании тантала - танталат).
В виде простых веществ ванадий, ниобий и тантал - серые тугоплавкие металлы, химически весьма инертны. При нагревании окисляются кислородом, фтором, хлором, азотом, углеродом:
t t
4V + 5O2 = 2V2O5; 2V + 5F2 = 2VF5
t
2Nb + 5Cl2 = 2NbCl5
Ванадий при обычных условиях растворим в царской водке и концентрированной плавиковой кислоте. При нагревании растворим в азотной и концентрированной серной кислоте. Ниобия и тантал растворяются в смеси плавиковой и азотной кислоты.
3Ta + 5HNO3 + 21HF = 3H2[TaF7] + 5NO + 10H2O
В присутствии окислителей ванадий, ниобий и тантал растворяются в щелочах:
4Nb + 5O2 + 12KOH = 4K3NbO4 + 6H2O
ниобат калия
Получают ванадий, ниобий и тантал металлотермическим способом из оксидов или комплексных фторидов:
t
Nb2O5 + 5Ca = 5CaO + 2Nb
t
K2[TaF7] + 5Na = 2KF + 5NaF + 2Ta
Продукты взаимодействия ванадия, ниобия и тантала с неметаллами малой активности (водород, азот, углерод, бор) представляют собой соединения переменного состава (ЭН, ЭN, Nb2N, TaN, ЭС, Э2С, ЭВ, ЭВ2) и отличаются высокой устойчивостью к воде и разбавленным кислотам.
Соединения в степени окисления +2 более или менее устойчивы только для ванадия, который образует оксид VO (VO0,9-1,3). Оксид ванадия(II) проявляет свойства основного оксида: реагирует с кислотами, образуя соли ванадия(II):
VO + 2H+ + 4H2O = [V(H2O)6]2+
Соли катиона V2+ окрашены в фиолетовый цвет, сильные восстановители, окисляются даже водой:
2V2+Cl2 + 2H2O = 2V3+(OH)Cl2 + H2
Степень окисления +3 также характерна только для ванадия. Основные соединения ванадия(III): оксид - V2O3 - и гидроксид - V2O3×nH2O - амфотерные соединения с преобладанием основных свойств, галогениды и соли катиона V3+. Производные ванадия(III) - сильные восстановители, в растворах окисляются кислородом воздуха:
4VCl3 + O2 + 4HCl = 4VCl4 + 2H2O
Соединения в степени окисления +4 для ванадия наиболее устойчивы. VO2 - амфотерный оксид, легко растворяющийся в растворах кислот и щелочей:
4VO2 + 2KOH = K2[V4O9] + H2O
VO2 + 2H+ + 4H2O = [VO(H2O)5]2+
Катион VO2+ (оксованадил или просто ванадил-катион) окрашен в светло-синий цвет и образует устойчивые соли со многими кислотами.
Галогениды ванадия(IV) гидролитически неустойчивы и в водных растворах быстро переходят в галогениды ванадила:
VCl4 + H2O = VOCl2 + 2HCl
Для ниобия и тантала описаны диоксиды, тетрагалогениды и оксодигалогениды - ЭОCl2. Все производные Nb(IV), Ta(IV) - сильные восстановители.
Для ванадия(V) известны только оксид V2O5 и пентафторид VF5. Для ниобия и тантала данная степень окисления наиболее устойчива.
Оксиды Э2О5 - тугоплавкие кристаллические вещества, проявляющие отчетливо выраженные кислотные свойства:
t
Э2О5 + 2КОН = 2КЭО3 + Н2О
Галогениды ЭНаl5 - вещества, имеющие молекулярное строение: фториды ниобия(V) и тантала(V) тетрамерны, хлориды и бромиды имеют димерное строение. Легкорастворимы в органических соединениях, летучи, водой нацело гидролизуются, склонны к образованию анионных координационных соединений:
2NbCl5 + 5H2O = Nb2O5 + 10HCl
TaF5 + 2KF = K2[TaF7]
Литература: [1] с. 619 - 633, [2] с. 489 - 523, [3] с. 478 - 481, 499 - 520
Лекция № 27. Элементы VIВ и VIIВ-подгрупп (подгруппы хрома и марганца)
27.1 Элементы VIВ-подгруппы (подгруппа хрома)
Элементы VIВ-подгруппы: хром - Cr, молибден - Mo, вольфрам - W, электронные аналоги с ожидаемой электронной формулой (n-1)d4ns2. Однако у атомов хрома и молибдена за счет провала электрона реализуется конфигурация (n-1)d5ns1. Содержание в земной коре: Cr - 8×10-3, Mo - 6×10-5, W - 1×10-5 мол.%. Основные минералы: Fe(CrO2)2 - хромистый железняк, PbCrO4 - крокоит, MoS2 - молибденит, CaWO4 - шеелит.
Хром получают, восстанавливая его оксид алюминием или кремнием:
t
Cr2O3 + 2Al = Al2O3 + 2Cr
Молибден и вольфрам получают, восстанавливая их оксиды водородом:
t
WO3 + 3H2 = W + 3H2O
В виде простых веществ хром, молибден и вольфрам представляют собой серовато-белые металлы с высокой плотностью и температурой плавления:
| Свойства | Cr | Mo | W |
| Плотность, г/см3 | 7,2 | 10,2 | 19,3 |
| Т.пл., °С |
В обычных условиях химически весьма инертны. При нагревании сгорают в атмосфере кислорода:
t t
4Cr + 3O2 = 2Cr2O3; 2W + 3O2 = WO3
Реакции с серой и галогенами протекают более сложно:
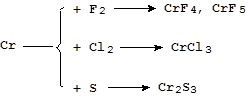
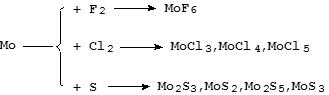
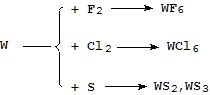
Реакции с азотом, фосфором, углеродом, кремнием и бором идут при высоких температурах с образованием соединений переменного состава - бертолидов.
В ряду хром - молибден - вольфрам наблюдается понижение химической активности, что иллюстрируется отношением металлов данной группы к кислотам. Хром растворим в соляной и разбавленной серной кислотах:
Сr + 2H+ = Cr2+ + H2
Концентрированные кислоты-окислители на холоду хром пассивируют. Молибден и вольфрам растворяются только в смеси плавиковой и концентрированной азотной кислоты при нагревании:
t
Mo + 2HNO3 + 8HF = H2[MoF8] + 2NO + 4H2O
В присутствии окислителей хром, молибден и вольфрам реагируют с расплавами щелочей:
t
2Cr + 3O2 + 4NaOH = 2Na2CrO4 + 2H2O
Раскаленные хром, молибден и вольфрам окисляются водой:
t t
2Cr + 3H2O = Cr2O3 + 3H2; W + 3H2O = WO3 + 3H2
Элементы подгруппы хрома способны проявлять все степени окисления от +1 до +6. Для молибдена и вольфрама наиболее устойчивы соединения в степени окисления +6, для хрома характерны степени окисления +2, +3 и +6.
В степени окисления +2 хром образует основной оксид - CrO, соответствующий ему гидроксид - Cr(OH)2 и соли. Все соединения хрома(II) - сильные восстановители, катион хрома(II) окисляется даже водой:
2CrCl2 + 2H2O = 2Cr(OH)Cl2 + H2
Степень окисления +3 для хрома наиболее устойчива и реализуется в оксиде - Cr2O3, гидроксиде - Cr(OH)3 и солях хрома(III). Оксид хрома(III) - темно-зеленый мелкокристаллический порошок, химически очень инертен. При сплавлении проявляет свойства амфотерного оксида:
t
Cr2O3 + 3K2S2O7 = Cr2(SO4)3 + 3K2SO4
t
Cr2O3 + 2KOH = 2KCrO2 + H2O
Гидроксид хрома(III) осаждается щелочами из водных растворов солей хрома(III) и представляет собой аморфное вещество серо-синего цвета, имеющее переменный состав Cr2O3×nH2O. Свежеосажденный гидроксид легко растворяется в растворах кислот и щелочей:
+ H+ + OH-
[Cr(H2O)6]3+ ¾ Cr(OH)3 ¾® [Cr(OH)6]3-
Соли катиона [Cr(H2O)6]3+ окрашены в фиолетовый цвет, выделяются из растворов в виде кристаллогидратов с большим содержанием воды: CrCl3×6H2O, Cr2(SO4)3×12H2O, K2SO4×Cr2(SO4)3×24H2O. Сульфат хрома и хромокалиевые квасцы широко применяются при выделке кож. Безводные соли хрома(III) имеют полимерное строение и в воде нерастворимы.
Степень окисления +6 реализуется в галогенидах, оксогалогенидах, оксидах хрома, молибдена и вольфрама и в некоторых анионных комплексах. Триоксиды - кристаллические вещества: CrO3 - красного цвета, MoO3 - белый, WO3 - желтый. Оксид хрома(VI) хорошо растворим в воде, образуя хромовую кислоту:
CrO3 + H2O = H2CrO4
Триоксиды молибдена и вольфрама в воде нерастворимы, но растворимы в щелочах, образуя соли:
MoO3 + 2KOH = K2MoO4 + H2O
Молибдаты и вольфраматы бесцветны, хроматы окрашены в желтый цвет. При подкислении раствора хроматы переходят в дихроматы и далее в полихроматы. В предельном случае из раствора выделяется оксид хрома(VI):
CrO42- + 2H+ = Cr2O72- + H2O
Переход обратим и при подщелачивании раствора вновь образуются хроматы:
Cr2O72- + 2OH- = 2CrO42- + H2O
Соединения молибдена(VI) и вольфрама (VI) явно выраженными окислительными свойствами не обладают. Хроматы и дихроматы - сильные окислители, при действии восстановителей восстанавливаются до соединений хрома(III):
K2Cr2O7 + 3NaNO2 + 4H2SO4 = Cr2(SO4)3 + K2SO4 + 3NaNO3 + 4H2O
K2Cr2O7 + 3NaNO2 + 4H2O = 2Cr(OH)3 + 2KOH + 3NaNO3
2K2CrO4 + 3NaNO2 + 2KOH + 5H2O = 2K3[Cr(OH)6] + 3NaNO3
Хром - одна из важнейших легирующих добавок, улучшающая физические свойства сталей и их устойчивость к коррозии. Благодаря устойчивости по отношению к агрессивным средам хром используется в качестве защитного покрытия (хромирование). Основное количество молибдена и вольфрама применяется в производстве легированных сталей. Молибденсодержащие стали используются для изготовления инструментов, валов турбин, броневых плит, стволов огнестрельного оружия. Вольфрамсодержащие стали характеризуются прочностью на истирание, устойчивостью к высоким температурам и химическим реагентам, пластичностью и упругостью.
Молибден - единственный элемент IV периода, относящийся к биометаллам. Входит в состав фермента нитрогеназа, играющего ключевую роль в процессе фиксации атмосферного азота клубеньковыми бактериями.
27.2. Элементы VIIВ-подгруппы (подгруппа марганца)
VIIВ-подгруппа включает марганец - Mn, технеций - Tc и рений - Re. Общая электронная формула (n-1)d5ns2 позволяет ожидать проявление всех степеней окисления от +1 до +7. Для марганца наиболее устойчивы соединения в степени окисления +2, +4 и +7. Для технеция и рения характерны степени окисления +4 и +7.
Марганец - довольно распространенный элемент земной коры, его кларк составляет 0,03 мол.%. Рений - редкий элемент (его кларк равен 8×10-9 мол.%). Технеций не имеет стабильных изотопов с большим периодом полураспада и встречается в земной коре в следовых количествах, получен искусственно. Минералы марганца: MnO2 - пиролюзит, Mn3O4 - гаусманит, Mn2O3 - браунит, Mn2O3×H2O - манганит. Основной минерал рения - CuReS4 - джезказганит.
Марганец получают восстановлением его оксидов алюминием или кремнием. Технеций получен облучением протонами молибдена-98:
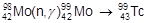
Рений получают восстановлением перрената аммония водородом:
t
2NH4ReO4 + 4H2 = 2Re + N2 + 8H2O
В виде простых веществ марганец, технеций и рений - металлы серебристо-белого цвета, с высокой плотностью и температурой плавления.
| Свойства | Mn | Tc | Re |
| Плотность, г/см3 | 7,3 | 11,5 | |
| Т.пл., °С |
Марганец довольно активный металл, особенно при повышенных температурах.
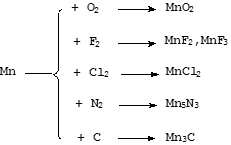
Чистый марганец устойчив к воде на при комнатной температуре и медленно реагирует с ней при нагревании. Примеси ускоряют данный процесс. Марганец, загрязненный углеродом, азотом и т.п., медленно реагирует с водой уже при комнатной температуре:
Mn + 2H2O = Mn(OH)2 + H2
В ряду стандартных электродных потенциалов марганец стоит левее водорода, поэтому легко растворяется в водных растворах кислот:
Mn + 2HCl = MnCl2 + H2
В растворах щелочей марганец в отсутствие окислителей устойчив.
В ряду марганец - технеций - рений химическая активность сильно уменьшается. Сгорая в атмосфере кислорода при нагревании, технеций и рений образуют оксиды в степени окисления +7:
t
4Tc + 7O2 = 2Tc2O7
Реакция с хлором приводит к образованию TcCl4 и ReCl5. Фтор реагирует с рением с образованием ReF6. По отношению к воде технеций и рений в обычных условиях устойчивы. Металлический технеций и рений растворяется в азотной кислоте, царской водке. Рений взаимодействует при нагревании с концентрированной серной кислотой, растворяется в щелочах в присутствии окислителей:
2Re + 7H2SO4 = 2HReO4 + 7SO2 + 6H2O
4Re + 4NaOH + 7O2 = 4NaReO4 + 2H2O
Оксид марганца(II) - MnO - зеленое кристаллическое вещество. Амфотерный оксид с явным преобладанием основных свойств, растворим в кислотах, в воде нерастворим. Кислотные свойства проявляются при сплавлении со щелочами или основными оксидами:
t
MnO + K2O = K2MnO2
При нагревании на воздухе окисляется:
t
2MnO + O2 = 2MnO2
Гидроксид марганца(II) - Mn(OH)2 - аморфный белый осадок, получающийся при действии щелочей на соли марганца(II):
Mn2+ + 2OH- = Mn(OH)2
В воде малорастворим, слабое основание. Легко взаимодействует с кислотами, со щелочами реагирует только при сплавлении или длительном нагревании:
t
Mn(OH)2 + 4OH- = [Mn(OH)6]4-
Легко окисляется кислородом:
2Mn(OH)2 + O2 = 2MnO2 + 2H2O
Описано большое число солей марганца(II), большинство из которых хорошо растворимы в воде. Малорастворимы MnF2, MnCO3, Mn3(PO4)2. Катион [Mn(H2O)6]2+ имеет слабую розовую окраску, такую же окраску имеют кристаллогидраты солей марганца(II). Все соли марганца(II) - сильные восстановители.
Основным соединением марганца(IV) является его диоксид - MnO2 - черно-бурое вещество, нерастворимое в воде, химически довольно инертное. MnO2 - амфотерный оксид с явным преобладанием кислотных свойств. Может проявлять свойства как окислителя, так и восстановителя:
t
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
t
3MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O
Соединения марганца(VII): оксид - Mn2O7, марганцевая кислота - HMnO4 и ее соли. Оксид марганца(VII) получается при действии концентрированной серной кислоты на перманганат калия:
2KMnO4 + 2H2SO4 = Mn2O7 + 2KHSO4 + H2O
Mn2O7 - темно-зеленая жидкость, крайне неустойчив, разлагается со взрывом. Типичный кислотный оксид, реагирует с водой с образованием марганцевой кислоты:
Mn2O7 + H2O = 2HMnO4
Марганцевая кислота - HMnO4 - сильная кислота, устойчива только в разбавленных растворах. Соли - перманганаты - более устойчивы, но при нагревании разлагаются с выделением кислорода:
t
2KMnO4 = K2MnO4 + MnO2 + O2
Перманганат-анион - сильнейший окислитель, глубина восстановления которого зависит от кислотности раствора:
MnO4- + 8H+ + 5e- ® Mn2+ + 4H2O, E0 = 1,58 В
MnO4- + 2H2O + 3e- ® MnO2 + 4OH-, E0 = 1,23 В
MnO4- + 1e- ® MnO42-, E0 = 0,56 В (при рН>7)
Основное количество марганца (чаще в виде сплава с железом - ферромарганца) применяется для раскисления чугуна и сталей. Стали с большим содержанием марганца (10-15 %) имеют большое сопротивление к удару и истиранию. Диоксид марганца применяется как катализатор и окислитель, KMnO4 применяется как окислитель и антисептик.
Марганец - биологически важный элемент, играет значительную роль в обмене веществ, влияет на процессы роста и размножения, а также кровообразования. Ускоряет образование антител, нейтрализует чужеродные белки. Внутривенным введением раствора MnSO4 удается спасти укушенных каракуртом. Важен марганец и для растений - ускоряет образование хлорофилла и витамина С. Повышает урожайность некоторых сельскохозяйственных культур, например, пшеницы и хлопчатника.
Рений используют в качестве добавки к сплавам и для изготовления электродов в рентгеновских трубках и радиолампах. Осаждением металлического рения получают зеркала с высокой отражательной способностью. Рений и его соединения применяют как катализаторы.
Литература: [1] с. 633 - 645, [2] с. 523 - 539, [3] с. 521 - 548
