Расчет значений рН водных растворов кислот, оснований и солей
Несмотря на то, что вода считается неэлектролитом, она частично диссоциирует с образованием катиона гидроксония и гидроксид-аниона:
H2O + H2O  H3O+ + OH-
H3O+ + OH-
Часто используют упрощенную форму записи данного процесса:
H2O  H+ + OH-
H+ + OH-
Это равновесие характеризуется соответствующей константой:
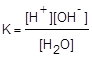
Поскольку в чистой воде и разбавленных водных растворах [H2O] = const, данное выражение можно преобразовать к следующему виду:
KW = [H+][OH-]
Полученная константа называется ионным произведением воды. При 25 °С KW = 10-14. Отсюда следует, что в чистой воде и нейтральных растворах [H+] = [OH-] = Ö10-14 = 10-7. Очевидно, что в кислых растворах [H+] > 10-7, а в щелочных [H+] < 10-7. На практике часто пользуются показателем концентрации катионов водорода - отрицательным десятичным логарифмом (pH = -lg[H+]). В кислых растворах рН < 7, в щелочных pH > 7, в нейтральной среде pH = 7. Аналогично можно ввести гидроксильный показатель pOH = -lg[OH-]. Водородный и гидроксильный показатели связаны простым соотношением: pH + pOH = 14.
Рассмотрим примеры расчета рН водных растворов сильных и слабых кислот.
Пример № 1. Сантимолярный раствор (0,01 моль/л) соляной кислоты (сильная одноосновная кислота).
HCl = H+ + Cl-
[H+] = CHCl = 0,01; pH = -lg 0,01 = 2
Пример № 2. Сантимолярный раствор (0,01 моль/л) гидроксида натрия (сильное однокислотное основание).
NaOH = Na+ + OH-
[OH-] = CNaOH = 0,01; pOH = -lg 0,01 = 2;
pH = 14 - pOH = 12
Пример № 3. Сантимолярный раствор (0,01 моль/л) уксусной кислоты (слабая одноосновная кислота).
CH3COO- + H+  CH3COOH
CH3COOH
Из уравнения реакции следует, что [H+] = [CH3COO-]. Для слабого электролита [CH3COOH] » C. Подставим эти формулы в константу кислотной диссоциации уксусной кислоты и преобразуем полученное выражение:
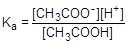 =1,75×10-5;
=1,75×10-5; 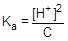 ; [H+] »
; [H+] » 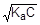
рН = - lg 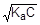 = -1/2(lgKa + lgC) = 1/2(pKa - lgC) = 1/2(4,75 + 2) = 3,38
= -1/2(lgKa + lgC) = 1/2(pKa - lgC) = 1/2(4,75 + 2) = 3,38
Пример № 4. Сантимолярный раствор (0,01 моль/л) аммиака (гидроксид аммония, слабое однокислотное основание).
NH3 + H2O  NH4+ + OH-
NH4+ + OH-
Из уравнения реакции следует, что [NH4+] = [OH-]. Так как гидроксид аммония слабый электролит, то [NH3] » C. Подставив эти формулы в константу ионизации аммиака как основания, получим:
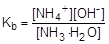 =1,8×10-5;
=1,8×10-5; 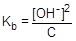 ; [OH-] =
; [OH-] = 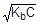
рOН = -lg 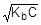 = 1/2(pKb - lgC);
= 1/2(pKb - lgC);
pH = 14 - pOH = 14 + 1/2(lgC - pKb) = 14 + 1/2(-2 - 4,76) = 10,62
Гидролиз солей. Отличие кислотности водных растворов солей от кислотности чистой воды определяется их гидролизом. Гидролиз - это обменное взаимодействие растворенного вещества с водой. По склонности к гидролизу соли делятся на четыре типа:
1. Соли, образованные сильной кислотой и сильным основанием (например, NaCl, Na2SO4), гидролизу не подвергаются. Водные растворы таких солей имеют нейтральную реакцию (рН = 7).
2. Соли, образованные слабым основанием и слабой кислотой, гидролизуются в значительной степени и часто необратимо, например,
Al2S3 + 6H2O = 2Al(OH)3¯ + 3H2S
Кислотность их растворов определяется более растворимым веществом, и обычно близка к нейтральной (рН » 7).
3. Соли, образованные слабым основанием и сильной кислотой, гидролизуются обратимо, связывая гидроксид-анионы, и обуславливая кислую реакцию растворов (рН < 7). Например, гидролиз хлорида аммония можно описать следующими уравнениями:
NH4+ + H2O  NH3×H2O + H+
NH3×H2O + H+
NH4Cl + H2O  NH3×H2O + HCl
NH3×H2O + HCl
Из приведенных уравнений видно, что гидролизу подвергается не вся соль, а только ее катион. Катионы солей, образованных многокислотными слабыми основаниями, гидролизуются ступенчато, последовательно отщепляя от воды гидроксид-анионы:
Al3+ + H2O  Al(OH)2+ + H+
Al(OH)2+ + H+
Al(OH)2+ + H2O  Al(OH)2+ + H+
Al(OH)2+ + H+
Al(OH)2+ + H2O  Al(OH)3 + H+
Al(OH)3 + H+
Суммарное уравнение гидролиза катиона алюминия имеет следующий вид:
Al3+ + 3H2O  Al(OH)3 + 3H+
Al(OH)3 + 3H+
4. Соли, образованные сильным основанием и слабой кислотой, гидролизуются по аниону, который отрывает от воды катион водорода. Освобождающиеся гидроксид-анионы придают раствору щелочную реакцию (pH > 7). Например, гидролиз ацетата натрия протекает следующим образом:
CH3COO- + H2O  CH3COOH + OH-
CH3COOH + OH-
CH3COONa + H2O  CH3COOH + NaOH
CH3COOH + NaOH
Очевидно, что гидролиз анионов солей слабых многоосновных кислот протекает ступенчато, например,
PO43- + H2O  HPO42- + OH-
HPO42- + OH-
HPO42- + H2O  H2PO4- + OH-
H2PO4- + OH-
H2PO4- + H2O  H3PO4 + OH-
H3PO4 + OH-
Суммарное уравнение гидролиза фосфат-аниона имеет следующий вид
PO43- + 3H2O  H3PO4 + 3OH-
H3PO4 + 3OH-
Гидролизу подвергаются не только соли, но и ковалентные неорганические и органические соединения. Например:
PCl3 + 3H2O = H3PO3 + 3HCl
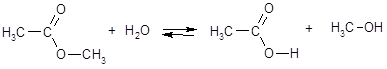
Важную роль в жизнедеятельности живых организмов играет гидролиз некоторых биомолекул - белков и полипептидов, жиров, а также полисахаридов.
Глубина протекания гидролиза характеризуется степенью гидролиза (h) - отношением количества вещества, подвергшегося гидролизу, к общему количеству вещества в растворе. Обратимый гидролиз может быть охарактеризован также константой. Например, для процесса гидролиза ацетат-аниона константа гидролиза записывается следующим образом:
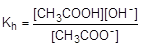
Равновесная концентрация воды в выражение константы гидролиза не входит, поскольку она постоянна и автоматически переносится в левую часть равенства.
Расчет константы и степени гидролиза, а также рНводных растворов солей рассмотрим на конкретных примерах.
Пример № 5. Сантимолярный раствор (0,01 моль/л ) хлорида аммония (соль, образованная слабым основанием и сильной кислотой). Запишем уравнение гидролиза в ионной форме и составим выражение для константы гидролиза.
NH4+ + H2O  NH3×H2O + H+
NH3×H2O + H+
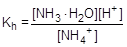
Умножив числитель и знаменатель правой части равенства на концентрацию гидроксид-ионов, константу гидролиза можно преобразовать следующим образом:
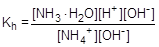
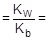
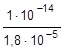 = 5,56×10-10
= 5,56×10-10
Из уравнения гидролиза следует, что [NH3×H2O] = [H+] = Ch, а [NH4+] = C - Ch = C(1-h). Соответственно,
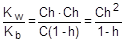
Так как h << 1, а (1-h) ® 1, полученное выражение можно упростить:
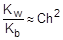 ; отсюда h »
; отсюда h » 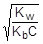
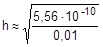 » 2,36×10-4 или 0,0236%
» 2,36×10-4 или 0,0236%
Из полученных уравнений видно, что константа и степень гидролиза соли увеличиваются с уменьшением константы диссоциации основания, т.е. с уменьшением его силы. Кроме этого, степень гидролиза и глубина его протекания увеличивается с уменьшением концентрации (увеличением разбавления) соли. Константа гидролиза, как и константа любого равновесия, от концентрации не зависит. Увеличение температуры приводит к увеличению степени и константы гидролиза, поскольку гидролиз - процесс эндотермический.
При расчете величины рН раствора соли учтем, что [NH3×H2O] = [H+], а в первом приближении [NH4+] » C.
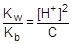 ; отсюда [H+] »
; отсюда [H+] » 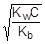
pH = - lg[H+] = -1/2(lgKw + lgC + pKb) = 7 - 1/2(pKb + lgC) = 7 - 1/2(4,76 - 2) = 5,62
Пример № 6. Сантимолярный раствор (0,01 моль/л) ацетата натрия (соль, образованная сильным основанием и слабой кислотой). Запишем уравнение гидролиза в ионной форме и составим выражение для константы гидролиза.
CH3COO- + H2O  CH3COOH + OH-
CH3COOH + OH-
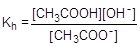
Умножив числитель и знаменатель правой части равенства на концентрацию катиона водорода, его можно преобразовать к следующему виду:
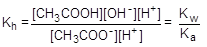 = 1×10-14/1,75×10-5 = 5,71×10-10
= 1×10-14/1,75×10-5 = 5,71×10-10
Из уравнения гидролиза следует, что [CH3COOH] = [OH-] = Ch, а [CH3COO-] = C - Ch = C(1-h).
Соответственно,
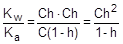 ;
; 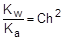 ; отсюда h =
; отсюда h = 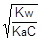
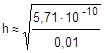 » 2,39×10-4 или 0,0239%
» 2,39×10-4 или 0,0239%
При расчете величины рН учтем, что [CH3COOH] = [OH-], а [CH3COO-] » C.
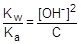 ; отсюда [OH-] »
; отсюда [OH-] » 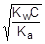 ;
;
pOH = -lg[OH-] = -1/2(lgKw + lgC + pKa) = 7 - 1/2(pKa + lgC)
pH = 14 - pOH = 7 + 1/2(pKa + lgC) = 7 + 1/2(4,75 - 2) = 9,75
Пример № 7. Сантимолярный раствор (0,01 моль/л) ацетата аммония (соль, образованная слабым основанием и слабой кислотой). Запишем уравнение гидролиза в ионной форме и составим выражение для константы гидролиза.
NH4+ + CH3COO- + H2O  NH3×H2O + CH3COOH
NH3×H2O + CH3COOH
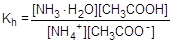
Умножив числитель и знаменатель правой части равенства на произведение концентрации катиона водорода и гидроксид-аниона (ионное произведение воды), его можно преобразовать следующим образом:
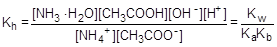 =
= 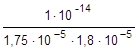 =0,32×10-4
=0,32×10-4
Из уравнения гидролиза следует, что [CH3COOH] = [NH3×H2O] = Ch, тогда
[CH3COO-] = [NH4+] = C - Ch = C(1-h), соответственно, 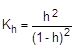
Отсюда 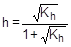 ;
;
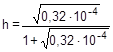 = 0,0056 или 0,56%
= 0,0056 или 0,56%
Образующаяся в результате гидролиза гидратированная молекула аммиака диссоциирует, отщепляя гидроксид-анион:
NH3×H2O  NH4+ + OH-
NH4+ + OH-
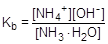 ; отсюда
; отсюда 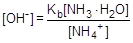
Аналогично, диссоциация уксусной кислоты обеспечивает образование катионов водорода:
CH3COO- + H+  CH3COOH
CH3COOH
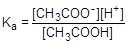 ; отсюда
; отсюда 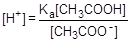
Найдем отношение концентраций данных ионов:
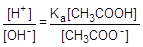 :
: 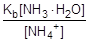
Согласно уравнению гидролиза [CH3COOH] = [NH3×H2O], а [CH3COO-] = [NH4+], тогда 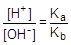
Так как [OH-] = Kw/[H+], то [H+]2 = 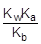 ; отсюда [H+] =
; отсюда [H+] = 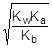
pH = - lg[H+] = 1/2(pKw + pKa - pKb) = 7 + 1/2(pKa - pKb) = 7 + 1/2(4,75 - 4,76) = 6,995
Литература: [1] с. 243 - 255; [2] с. 296 - 302
