Основные положения метода валентных связей
¨ Ковалентная связь реализуется за счет образования общей электронной пары.
¨ Общая электронная пара образуется при перекрывании электронных орбиталей взаимодействующих атомов.
Степень перекрывания и прочность связи зависит от энергетического и геометрического соответствия орбиталей. При прочих равных условиях прочность связи увеличивается с уменьшением разности энергии взаимодействующих орбиталей и увеличением плотности электронного облака:
1s - 1s > 1s - 2s > 1s - 3s 1s - 1s > 2s - 2s > 3s - 3s
Необходимым условием эффективного перекрывания орбиталей является надлежащая их ориентация в пространстве и совпадение математического знака волновой функции:
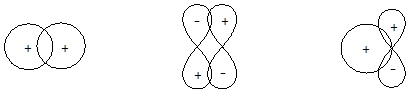
Эффективное перекрывание Нулевое перекрывание Неэффективное перекрывание
Выделяют два механизма образования общей электронной пары - обменный и донорно-акцепторный. При реализации обменного механизма каждый из взаимодействующих атомов предоставляет на образование общей электронной пары неспаренный электрон, занимающий валентную орбиталь:
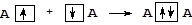
При образовании ковалентной связи по донорно-акцепторному механизму один из атомов (D) выступает в качестве донора, предоставляя в общее пользование неподеленную пару электронов, расположенную на одной из его валентных орбиталей. Второй атом - акцептор (А) - предоставляет на образование связи вакантную орбиталь, принимая на нее электронную пару партнера-донора:
По числу общих электронных пар, связывающих атомы, различают простые, двойные и тройные связи:
H2N:NH2 или H2N-NH2 HN::NH или HN=NH N:::N или NºN
Известны немногочисленные примеры соединений, содержащих четырехкратные связи металл-металл, например,
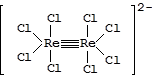
По характеру перекрывания электронных орбиталей выделяют три типа ковалентной связи:
s-Связь,при образовании которой перекрывание орбиталей происходит вдоль линии связи (линии, соединяющей ядра взаимодействующих атомов).
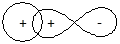
p-Связь,при образовании которой перекрывание орбиталей происходит в плоскости, содержащей линию связи (боковое перекрывание).
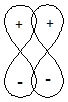
d-Связь,при образовании которой перекрывание орбиталей происходит в плоскости, перпендикулярной линии связи.
Физическими характеристиками химической связи и молекулярной частицы являются энергия связи, длина связи и валентный угол, а также полярность и поляризуемость. Энергия химической связи - это количество энергии, необходимое для ее разрыва. Такое же количество энергии выделяется при образовании связи. Так энергия диссоциации молекулы водорода составляет 435 кДж/моль, соответственно, EH-H = 435 кДж/моль. Расстояние между ядрами химически связанных атомов называется длиной связи. Измеряется длина связи в нм (нанометр, 1×10-9 м) или пм (пикометр, 1×10-12 м). Угол между условными линиями, соединяющими ядра химически связанных атомов (линиями связи), называется валентным. Например, молекула воды имеет угловую форму
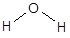
с валентным углом НОН 104,5° и длиной связей О-Н 96 пм. Энергия, необходимая для полной диссоциации молекулы, т.е. для осуществления процесса H2O ® 2H + O, составляет 924 кДж/моль, средняя энергия связи О-Н равна 462 кДж/моль (924/2).
В том случае, когда ковалентная связь образуется атомами с одинаковой электроотрицательностью, общая электронная пара в равной мере принадлежит обоим партнерам. Такая связь называется ковалентной неполярной. Если же атомы, образующие связь, отличаются по электроотрицательности, общая электронная пара смещена к атому с большей электроотрицательностью. Образующаяся связь называется ковалентной полярной. Вследствие несимметричного распределения электронной плотности двухатомные молекулы с ковалентной полярной связью представляют собой диполи - электронейтральные частицы, центры тяжести положительного и отрицательного заряда в которых не совпадают. При написании формул полярность ковалентной связи передают несколькими способами:
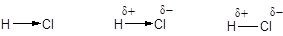
Количественной характеристикой полярности связи является ее дипольный момент, точнее электрический момент диполя:
m = d×qe×l,
где qe - заряд электрона, l - длина связи.
Единицей измерения дипольного момента является Кл×м (SI) или внесистемная единица - Дебай (D = 3,34×10-30 Кл×м). Дипольный момент молекулы определяется как векторная сумма дипольных моментов ее связей и неподеленных электронных пар. Вследствие этого молекулярные частицы, имеющие одинаковую форму, но связи разной полярности, могут иметь различные дипольные моменты. Например:
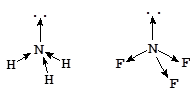
m = 1,47 D m = 0,2 D
Важной характеристикой ковалентной связи, в значительной мере определяющей ее реакционную способность, является поляризуемость - способность связи изменять полярность (перераспределять электронную плотность) под действием внешнего электростатического поля, источником которого могут служить катализатор, реагент, растворитель и т.д. Наведенный диполь частицы связан с напряженностью внешнего поля (Е) простым соотношением: m = aЕ. Коэффициент пропорциональности a является количественной характеристикой поляризуемости.
Ковалентная связь обладает двумя важнейшими свойствами - насыщаемостью и направленностью. Насыщаемость ковалентной связи заключается в том, что атомы способны к образовании конечного числа ковалентных связей. Причиной насыщаемости ковалентной связи является ограниченное число валентных орбиталей атома, необходимых для образования связи как по обменному, так и по донорно-акцепторному механизму.
Количественно насыщаемость ковалентной связи характеризуется ковалентностью. Ковалентность (структурная валентность - v) равна числу ковалентных связей, образованных атомом как по обменному, так и по донорно-акцепторному механизму.
Зная число орбиталей на валентных электронных уровнях, можно рассчитать максимальную теоретически возможную валентность для элементов разных периодов. У атомов элементов первого периода на валентном (первом) уровне находится только одна орбиталь (1s), поэтому водород во всех своих соединениях одновалентен. Гелий, атом которого имеет полностью завершенный первый уровень, химических соединений не образует.
У элементов второго периода валентным является второй энергетический уровень, содержащий четыре орбитали - 2s, 2px, 2py, 2pz. По этой причине максимальная ковалентность элементов второго периода равна четырем. Например, для азота:
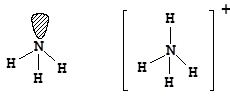
vN = 3; vN = 4
Направленность ковалентной связи обусловлена стремлением атомов образовать связи в направлении наибольшего перекрывания орбиталей, что обеспечивает максимальный выигрыш энергии. Это приводит к тому, что молекулы, образованные с участием ковалентных связей, имеют строго определенную форму. Например, образование связей сера - водород в молекуле сероводорода происходит за счет перекрывания электронных облаков 1s-орбиталей атомов водорода и двух 3p-орбиталей атома серы, расположенных под прямым углом друг к другу. Вследствие этого молекула сероводорода имеет угловую форму и валентный угол HSH, близкий к 90°.
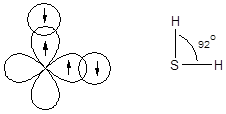
Поскольку форму ряда молекул нельзя объяснить образованием ковалентных связей с участием стандартного набора атомных орбиталей, Л. Полинг разработал теорию гибридизации атомных орбиталей. Согласно этой теории процесс образования молекулярной частицы сопровождается выравниваем длины и энергии ковалентных связей за счет процесса гибридизации атомных орбиталей, который можно представить как смешивание волновых функций базисных атомных орбиталей с образованием нового набора эквивалентных орбиталей. Процесс гибридизации требует затраты энергии, но образование связей с участием гибридных орбиталей энергетически выгодно, так как обеспечивает более полное перекрывание электронных облаков и минимальное отталкивание образующихся общих электронных пар. Условием устойчивой гибридизации является близость исходных атомных орбиталей по энергии. При этом, чем меньше энергия электронного уровня, тем более устойчивой является гибридизация.
Наиболее простой является sp-гибридизация, которая реализуется при смешивании волновых функций s- и одной р-орбитали:
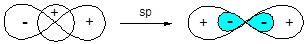
Образующиеся sp-гибридные орбитали ориентированы по одной оси в разные стороны, что обеспечивает минимальное отталкивание электронных пар, поэтому угол между связями, образованными с участием данных орбиталей составляет 180°.
Участие в гибридизации s- и двух p-орбиталей приводит к образованию трех гибридных орбиталей (sp2-гибридизация), ориентированных от центра к вершинам правильного треугольника. Валентный угол между связями, образованными с участием гибридных орбиталей данного типа составляет 120°.
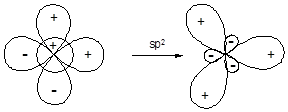
sp3-Гибридизация приводит к образованию набора из четырех энергетически равноценных орбиталей, ориентированных от центра к вершинам тетраэдра под углом 109,5° по отношению друг к другу:
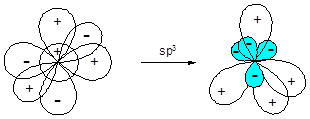
Рассмотрим в качестве примера строение некоторых молекул, образованных с участием sp3-гибридных орбиталей.
Молекула метана - CH4
Из энергетической диаграммы атома углерода следует, что имеющихся двух неспаренных электронов недостаточно для образования четырех ковалентных связей по обменному механизму, поэтому образование молекулы метана происходит с участием атома углерода в возбужденном состоянии.
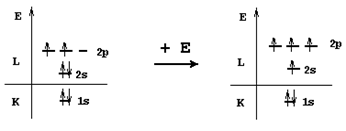
Равноценность связей и тетраэдрическая геометрия молекулы метана указывает на образование связей с участием sp3-гибридных орбиталей центрального атома.
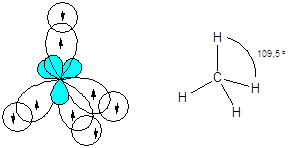
Молекула аммиака - NH3
Атомные орбитали азота в молекуле аммиака находятся в состоянии sp3-гибридизации. Три орбитали задействованы в образовании связей азот - водород, а четвертая - содержит неподеленную электронную пару, поэтому молекула имеет пирамидальную форму. Отталкивающее действие неподеленной пары электронов приводит к уменьшению валентного угла от ожидаемого 109,5 до 107,3°.
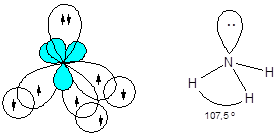
Наличие у атома азота неподеленной электронной пары позволяет ему образовать еще одну ковалентную связь по донорно-акцепторному механизму. Таким образом происходит образование молекулярного катиона аммония - NH4+. Образование четвертой ковалентной связи приводит к выравниванию валентных углов (a = 109,5°) за счет равномерного отталкивания атомов водорода:
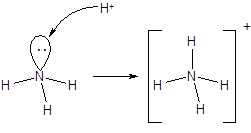
Симметричность катиона аммония, а также геометрическая и энергетическая равноценность связей азот-водород свидетельствует об эквивалентности ковалентных связей, образованных по обменному и донорно-акцепторному механизму.
Молекула воды - H2O
Образование молекулы воды происходит с участием sp3-гибридных орбиталей атома кислорода, две из которых заняты неподеленными электронными парами и поэтому вклада в геометрию молекулы не вносят. Перекрывание одноэлектронных облаков двух гибридных орбиталей кислорода и 1s-орбиталей двух атомов водорода приводит к образованию уголковой молекулы. Отталкивающие действие двух неподеленных пар электронов уменьшает валентный угол HOH до 104,5°.
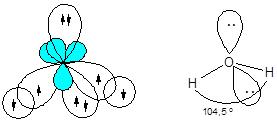
Наличие двух неподеленных пар электронов позволяет молекуле воды образовывать еще одну связь кислород - водород по донорно-акцепторному механизму, присоединяя катион водорода и образуя молекулярный катион гидроксония:
H2O + H+ ® H3O+
Рассмотренные примеры иллюстрируют преимущества метода ВС, в первую очередь, его наглядность и простоту рассмотрения строения молекулы на качественном уровне. Присущи методу ВС и недостатки:
· Метод ВС не позволяет описать образование одноэлектронных связей, например, в молекулярном катионе Н2+.
· Метод ВС не позволяет описать образование делокализованных многоцентровых связей. Для описания молекул с делокализованными связями в рамках метода ВС вынуждено прибегают к специальному приему - резонансу валентных схем. Согласно концепции резонанса строение молекул такого типа передается не одной формулой, а наложением нескольких валентных схем (формул). Например, строение молекулы азотной кислоты, содержащей делокализованную трехцентровую связь
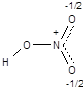
в методе ВС передается наложением (резонансом) двух валентных схем:
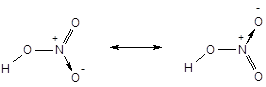
· Метод валентных связей не всегда адекватно отражает физические свойства молекул, в частности, их магнитное поведение. Например, согласно методу ВС, молекула кислорода должна быть диамагнитной, поскольку все электроны в ней спарены. Реально же молекула кислорода представляет собой бирадикал и является парамагнитной.
· Метод ВС не может объяснить спектры поглощения и окраску веществ, поскольку не рассматривает возбужденные состояния молекул.
· Математический аппарат метода валентных связей довольно сложен и громоздок.
Литература: [1] с. 109 - 135; [2] с. 104 - 118; [3] с. 70 - 90
