Лабораторная работа №1: «Качественные реакции на отдельные ионы и вещества».
1. Качественная реакция на Cl-. В пробирку налить 2 мл раствора хлорида натрия, добавить 3-4 капли раствора AgNO3. Наблюдается выпадение белого творожистого осадка Записать уравнение реакции в молекулярном и ионном видах.
2. Качественная реакция на SO42-. В пробирку налить 2 мл раствора Na2SO4, добавить 3-4 капли BaCl2. Наблюдается выпадение белого осадка BaSO4. Записать уравнение реакции в молекулярном и ионном видах.
3. Качественная реакция на ион Fe3+.В пробирку налить 2 мл раствора FeCl3, добавить 3-4 капли раствора KSCN. Наблюдать изменение окраски раствора. Указать цвет полученного раствора. Записать уравнение реакции в молекулярном виде.
4. Качественная реакция на ион Fe2+. В пробирку налить 2 мл раствора FeSO4, добавить 3-4 капли раствора K3[Fe(CN)6]. Наблюдается изменение окраски раствора. Реакция протекает в соответствии с уравнением:
FeSO4 + K3[Fe(CN)6] → KFe[Fe(CN)6]↓ + K2SO4
турнбулева синь.
5. Качественная реакция на ионы Pb2+.В пробирку налить 2 мл раствора Pb(CH3COO)2 и добавить 3-4 капли раствора KI, наблюдать выпадение желтого осадка йодида свинца. Записать уравнение реакции в молекулярной и ионной формах.
6. Качественная реакция на ионы Cu2+.В пробирку налить 2 мл раствора CuSO4 и добавить 3-4 капли раствора гидроксида натрия, происходит образование голубого осадка гидроксида меди, записать уравнение реакции в молекулярной и ионной формах:
К полученному осадку добавить избыток NH4OH, осадок растворяется в результате образования комплексного соединения ярко-синего цвета.
Сu(OH)2 + 4NH4OH → [Cu(NH3)4](OH)2 + 4Н2О.
7. Качественная реакция на ионы NH4+. В пробирку внести по 0,5 мл раствора NH4Cl и NaOH. Нагреть пробирку до кипения. Выделение аммиака обнаруживается по запаху. Записать уравнение реакции в молекулярной и ионной формах.
8. Качественная реакция на фенол.В пробирку налить 2 мл раствора фенола и добавить 3-4 капли раствора хлорного железа. Фиолетовая окраска полученного раствора свидетельствует об образовании фенолята железа(III) в соответствии с уравнением:
С6H5OH + FeCl3 → С6H5OFeCl2 + HCl.
Лабораторная работа №2: «Определение молярной концентрации эквивалента раствора
Соляной кислоты методом алкалиметрии».
Ход работы:
- Бюретку заполнить рабочим раствором гидроксида натрия (Сf = 0,1 н) до нулевого деления.
- Пипеткой отмерить точный объем - 10 мл раствора соляной кислоты неизвестной концентрации и перенести в колбу для титрования.
- В раствор кислоты добавить 2-3 капли индикатора - фенолфталеина, содержимое перемешать.
- Титровать раствор кислоты рабочим раствором щелочи, медленно, по каплям, постоянно перемешивая, до появления устойчивой розовой (малиновой) окраски, которая свидетельствует об окончании титрования – достижении точки эквивалентности.
- Определить по делениям на бюретке точный объем рабочего раствора, который был израсходован на титрование. Титрование провести трижды и рассчитать средний объем рабочего раствора из трех опытов:
| VHCl(мл) | VNaOH (мл) | Vcp |
| V1 | ||
| V2 | ||
| V3 |
Допустимое расхождение 0,2 мл
- Произвести расчет и определить молярную концентрацию эквивалента кислоты:
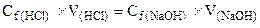
Занятие №2. Тема: «Тепловые эффекты химических реакций. Направленность процессов. Кинетика биохимических реакций. Химическое равновесие.
Принцип Ле-Шателье».
1. Вопросы для обсуждения:
1. Предмет и задачи термодинамики. Химическая термодинамика.Термодинамические системы, их классификация. Параметры и функции термодинамических систем.
2. Первое начало термодинамики. Внутренняя энергия. Энтальпия. Закон Гесса, следствия из него. Термохимия. Калориметрия.
3. Второе начало термодинамики. Энтропия. Направление самопроизвольного протекания реакции. Свободная энергия Гиббса, Гельмгольца.
4. Особенности живых организмов как термодинамических систем.
5. Химическая кинетика. Механизмы и скорость химических реакций. Гомогенные и гетерогенные реакции. Факторы, влияющие на скорость протекания реакции (природа реагирующих веществ, площадь поверхности, концентрация, температура, давление, энтропия активации, энергия активации, катализаторы).
6. Закон действия масс. Порядок реакции.
7. Зависимость скорости реакции от температуры. Уравнения Вант-Гоффа и Аррениуса.
8. Катализ и катализаторы. Гомогенный и гетерогенный катализ. Понятие об обратимых и необратимых процессах.
9. Понятие о химическом равновесии. Константа химического равновесия. Принцип Ле-Шателье. Факторы смещения химического равновесия (температура, концентрация, давление).
10. Связь между изменением свободной энергией Гиббса и константой химического равновесия.
11. Проявление принципа Ле-Шателье в живых организмах (сопряженные реакции).
2. Ситуационные задачи:
| № | Текст задания: |
| 1. | Рассчитать тепловой эффект реакции (ΔНº р-ции) при н.у: 4NН3(г)+5О2(г)→4NO(г)+6Н2О(ж), пользуясь справочными значениями стандартных теплот (энтальпий) образования веществ. |
| 2. | Рассчитать стандартную энтальпию реакции 2SО2(г)+О2(г)→2SО3(г). Указать, будет ли данная реакция экзо- или эндотермической. |
| 3. | Рассчитать изменение энтропии реакции при стандартных условиях: СН4(г)+2О2(г)→СО2(г)+2Н2О(ж), использовав табличные данные. |
| 4. | Возможно ли самопроизвольное протекание реакции (подтвердить расчетами): С6Н12О6 → 2 СзН6Оз Глюкоза Молочная к-та |
| 5. | Оксид азота (II) взаимодействует с хлором согласно уравнению: 2NO(г) + Cl2(г) ® 2NOCl(г). Константа скорости для этой реакции соответствует 2,2∙104 л/(моль∙с). Рассчитать скорость образования NOCl, если концентрация NO = 1,00∙10-6 моль/л, концентрация Cl2 = 0,50∙10-6 моль/л. Реакция имеет второй порядок по NO и первый порядок по Cl2. |
| 6. | При повышении температуры на 300 К скорость реакции увеличилась в 64 раза. Вычислить температурный коэффициент (γ). |
| 7. | В каком направлении сместится химическое равновесие в системе: CO2(г) + С(т) ↔ 2CO(г), ΔH = +171 кДж/моль. а)при повышении температуры? б)при повышении концентрации СО2? |
| 8. | Какой из процессов должен проводиться при высоком давлении? А)N2(г) + 3H2(г) ↔ 2NH3(г), В)CO2(г) + С(т) ↔ 2CO(г), С)Fe3O4(т) + 4H2(г) ↔ 3Fe(т) + 4H2O(г). |
| № | Эталоны ответов: |
| 1. | В соответствии с первым следствием из закона Гесса ΔНº р-ции = ∑ ΔНºобр(прод. р-ции) - ∑ ΔНº обр.(исх. в-в); ΔНº р-ции = [4 ´ ΔНº обр(NO)г + 6 ´ ΔНº обр.(Н2О)ж] – [4 ´ ΔНºобр.(NHз)г + 5 ´ ΔНºобр.(О2)г]. ΔНº р-ции = [4 ´ 91 + 6 ´ (-286) ] - [4 ´ (-46) + 5 х 0] = -1168 кДж, процесс экзотермический. |
| 2. | 2SО2(г) + О2(г) = 2SО3(г); 2 1 2 моль ΔНº = ∑ ΔНобрº (прод.) - ∑ ΔНобрº (реаг.) = [2 (-396)] - [2 (-297) + 1(0)] = -198 кДж. Стандартная энтальпия реакции равна -198 кДж. Реакция экзотермическая. |
| 3. | ΔSº = [2Sº(Н2О(ж)) + Sº(СО2 (г))] – [Sº(СН4(г)) + 2Sº(О2(г))] ΔSº = [2´70 + 213,7] – [186,3 + 2´205,0] = -242,4 Дж´К-1. |
| 4. | Необходимо рассчитать величину свободной энергии Гиббса, т.к. она является критерием самопроизвольно протекающего процесса. По таблице найти значение энергии Гиббса глюкозы и молочной кислоты. ΔGº(реакции) = ∑ ΔGобрº(продуктов реакции) - ∑ ΔGобрº(исходных веществ) ΔGº(реакции) =[2´ (-539)] - [-917]= -161 кДж. Реакция может протекать самопроизвольно в стандартных условиях, т.к.ΔG < 0. |
| 5. | Кинетическое выражение скорости для реакции 2NO (г) + Cl2 (г) ® 2NOCl (г) = 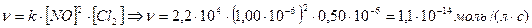 . . |
| 6. | Используя формулу 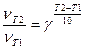 , где υT2 – скорость реакции при Т2, υT1 – скорость реакции при Т1, γ – температурный коэффициент (предел от 2-4), рассчитать, что , где υT2 – скорость реакции при Т2, υT1 – скорость реакции при Т1, γ – температурный коэффициент (предел от 2-4), рассчитать, что 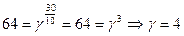 |
| 7. | а)Тепловой эффект реакции, ΔHр > 0, процесс эндотермический. По принципу Ле-Шателье, при повышении температуры, равновесие в системе смещается в сторону эндотермической реакции, следовательно, при повышении температуры в системе CO2(г) + С(т) ↔ 2CO(г), равновесие сместится в сторону выхода СО (продукт реакции). Б)По принципу Ле-Шателье, при увеличении концентрации одного из реагентов, равновесие в системе смещается в сторону расхода этого реагента, следовательно, равновесие сместится в сторону продуктов реакции (выход угарного газа). |
| 8. | По принципу Ле-Шателье, при повышении давления, равновесие в системе смещается в сторону меньшего объема газов, следовательно, в реакции А при повышении давления равновесие сместится в сторону образования аммиака (объем газа = 2), в реакции Б – в сторону образования СО2 (исходные вещества), в реакции В равновесие системы не сместится (равные объемы газовой фазы). |
3. Выполнить тестовые задания (письменно):
| 1. | Стандартные термодинамические величины характеризуют состояние системы при следующих значениях температуры и давления: | |
| А | t = 0oС, p =1 атм | |
| Б | t =20oС, p = 101,3 кПа | |
| В | Т = 298оК, p = 101,3 кПа | |
| Г | Т = 273оК, p = 101,3 кПа | |
| 2. | Определить, какое математическое выражение соответствует первому закону термодинамики. | |
| А | ΔG = ΔH - TΔS | |
| Б | P = icRT | |
| В | ΔU = Q - A | |
| Г | ΔS = ΔQ / T | |
| 3. | Какая из формул является математическим выражением закона Гесса: | |
| А | ΔН (реак.) = ΔH1 + ΔН2 + ΔН3 | |
| Б | Δ Н (реак.) = ∑ΔН(обр. кон. в-в.) - ∑ΔН(обр. исх. в-в.) | |
| В | ΔН(реак.) = ΔG + ТΔS | |
| Г | ΔН(реак.) = ΔG - ТΔS | |
| 4. | Какая из формул относится к первому следствию из закона Гесса: | |
| А | ΔН (реак.) = ΔH1 + ΔН2 + ΔН3 | |
| Б | Δ Н (реак.) = ∑ΔНобр (кон. в-в.) - ∑ΔНобр ( исх. в-в.) | |
| В | ΔН(реак.) = ΔG + ТΔS | |
| Г | ΔН(реак.) = ΔG-ТΔS | |
| 5. | Энтальпия системы является мерой её: | |
| А | Обратимости | |
| Б | Неупорядоченности | |
| В | Теплосодержания | |
| Г | Упорядоченности | |
| 6. | Энтропия системы является мерой её: | |
| А | Обратимости | |
| Б | Неупорядоченности | |
| В | Теплосодержания | |
| Г | Теплового эффекта | |
| 7. | В экзотермической реакции... | |
| А | Энтальпия реакционной системы повышается (ΔН > 0 ) | |
| Б | Энтропия реакционной системы уменьшается (S < 0 ) | |
| В | Энтальпия реакционной системы уменьшается ( ΔН < 0 ) | |
| Г | Давление реакционной системы повышается | |
| 8. | Какая из написанных ниже реакций отвечает теплоте образования оксида азота (II) в стандартных условиях (ΔНо298) | |
| А | ½N2 + О = NО | |
| Б | N + ½О2 = NО | |
| В | ½N2 + ½О2 = NО | |
| Г | 2NН3 + 5/2О2 = 2 NO + 3Н2О | |
| 9. | Определить, какое математическое выражение соответствует второму закону термодинамики. | |
| А | P = cRT | |
| Б | ΔG = ΔH - TΔS | |
| В | Q = ΔU - A | |
| Г | N = kp | |
| 10. | Какое из условий способствует самопроизвольному протеканию реакции: | |
| А | Δ G > 0 | |
| Б | Δ G < 0 | |
| В | Δ G = 0 | |
| 11. | Скорость химической реакции - это: | |
| А | время, за которое полностью расходуется одно из исходных веществ | |
| Б | время, за которое заканчивается реакция | |
| В | количества вещества, реагирующего за единицу времени в единице объема | |
| Г | количество вещества продуктов реакции к моменту окончания реакции | |
| 12. | Единицами измерения скорости химической реакции являются: | |
| А | л/(моль·сек) | |
| Б | моль/л | |
| В | л/моль | |
| Г | моль/(л·сек) | |
| 13. | Указать кинетическое уравнение в общем виде для реакций нулевого порядка: | |
| А | υ = k | |
| Б | υ = k [A] | |
| В | υ = k [A] [B] | |
| Г | υ = k [A]2 [B] | |
| 14. | Общий порядок реакции в кинетическом уравнении υ = k [CO] [H2]2 равняется: | |
| А | ||
| Б | ||
| В | ||
| Г | ||
| 15. | Кинетическое уравнение реакции υ = k [A]2 [B]. Указать во сколько раз уменьшится скорость химической реакции при уменьшении концентрации реагирующих веществ в два раза | |
| А | ||
| Б | ||
| В | ||
| Г | ||
| 16. | Указать во сколько раз возрастает скорость химической реакции при повышении температуры на 10оС | |
| А | в 5 раз | |
| Б | в 2-4 раза | |
| В | в 5-6 раз | |
| Г | в 0,1-0,5 раз | |
| 17. | Катализатор увеличивает скорость химической реакции, потому что: | |
| А | Уменьшает энергию активации | |
| Б | Увеличивает энергию активации | |
| В | Не влияет на энергию активации | |
| Г | Сначала увеличивает, а потом уменьшает энергию активации | |
| 18. | В каком направлении сместится химическое равновесие в системе CO2(г) + С(т) ↔ 2CO(г) ΔH= +171 кДж/моль при повышении температуры? | |
| А | Вправо | |
| Б | Влево | |
| В | Не сместится | |
| 19. | В какую сторону сместится равновесие в системе H2 + Cl2 ↔ 2HCl ΔH = -91,8кДж/моль при понижении температуры? | |
| А | Вправо | |
| Б | Влево | |
| В | Не сместится | |
| 20. | В какую сторону сместится химическое равновесие в системе CuO(т)+H2(г)↔Cu(т)+H2O(г) при повышении давления? | |
| А | В сторону исходных веществ | |
| Б | В сторону продуктов реакции | |
| В | Не сместится |
4. Задачи для самостоятельного решения (выполнить письменно):
| 1. | Рассчитать тепловой эффект реакции: 2NaOH(к) + СО2(г) → Na2CO3(к) + Н2О(ж), если ΔНºобр. (NaOH) = -426,6 кДж/моль, ΔНºобр. (СО2) = -393,6 кДж/моль, ΔНºобр. (Nа2СO3) = -1129,3 кДж/моль, ΔНºобр. (H2O) = -285,8 кДж/моль |
| 2. | Возможно ли самопроизвольное протекание реакции (подтвердить расчетами): SiO2(к) + 2NaOH(раствор) → Na2SiO3(к) + H2O(ж), если ΔGºобр (NaOH) = -415,5 кДж/моль, ΔGº обр (SiО2) = -803,75 кДж/моль, ΔGºобр (Nа2SiO3) = -1427,8 кДж/моль, ΔGº обр (H2O) = -237,5 кДж/моль |
| 3. | Во сколько раз изменится скорость химической реакции 2SO2 + O2 = 2SO3, если концентрацию исходных веществ увеличить в 3 раза? |
| 4. | Химическая реакция при 100 С заканчивается за 16 мин. При какой температуре она закончится за 1 мин, если температурный коэффициент скорости реакции = 2? |
| 5. | В каком направлении сместится равновесие в системе: А) 2СO + O2 = 2СO2, ΔH = -566 кДж\моль Б) N2 + O2 = 2NO, ΔH = 180 кДж\моль при повышении давления, при понижении температуры? |
| 6. | Как повлияет на равновесие следующих реакций: А) 2Н2 + О2 = 2Н2О, ΔH = -483,6 кДж\моль Б) СаСО3 (т) = СаО (т) + СО2 (г), ΔH = 179 кДж\моль повышение давления, повышение температуры? |
| 7. | Указать, какими изменениями концентраций реагирующих веществ можно сместить вправо равновесие реакции СO2 + С (графит) = 2СO |
9. Тематика рефератов по учебно-исследовательской работе студентов (УИРС).
| 1. | Химическая термодинамика – теоретическая основа изучения обмена веществ и энергии в живом организме. |
| 2. | Особенности живых организмов, как объектов для термодинамических исследований. |
| 3. | Кинетика биохимических реакций. |
| 4. | Катализаторы в живом организме. |
| 5. | Приложение принципа Ле-Шателье к газообмену в организме человека. |
| 6. | Особенности равновесных процессов в живых организмах. |
Лабораторная работа №1: „Зависимость скорости химической реакции от концентрации реагирующих веществ”.
Химическая реакция протекает по уравнению: Na2S2O3 + H2SO4 → Na2SO4 + S + SO2 + H2O
Как видно из уравнения реакции, разложение тиосульфата в кислой среде сопровождается выделением серы (раствор мутнеет) и выделением газа (специфический запах). Время от начала опыта до достижения определенной степени помутнения раствора можно принять за время прохождения реакции.
Ход работы:
1 этап: В три стаканчика налить раствор тиосульфата натрия и дистиллированную воду, в количествах, указанных в таблице ниже. Затем в каждый из стаканчиков добавить при помешивании раствор серной кислоты. В каждом случае зафиксировать время от начала добавления серной кислоты до появления мутности, результаты отразить в таблице.
| № опыта | V (Na2S2O3) мл | V (H2O) мл | V (H2SO4) мл | Время появления мутности (с) | Скорость ( 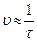 ), c-1 ), c-1 |
Сделать вывод о влиянии концентрации Na2S2O3 на скорость реакции. Предположить порядок данной реакции по тиосульфату натрия.
2 этап:В три стаканчика налить раствор серной кислоты и дистиллированную воду, в количествах, указанных в таблице ниже. Затем в каждый из стаканчиков добавить при помешивании тиосульфата натрия раствор. В каждом случае зафиксировать время от начала добавления Na2S2O3 до появления мутности, результаты отразить в таблице.
| № опыта | V (H2SO4) мл | V (H2O) мл | V (Na2S2O3) мл | Время появления мутности (с) | Скорость ( 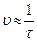 ), c-1 ), c-1 |
Сделать вывод о влиянии концентрации серной кислоты на скорость реакции. Предположить порядок данной реакции по серной кислоте.
Сделать суммарный вывод.
